题目内容
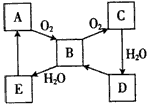
 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).回答下列问题:
(1)化合物E的沸点高于化合M的沸点,原因是
(2)甲、乙两种元素可以形成两种化合物,其中一种化合物含有4个原子核,该化合物的结构式为
(3)E与D高温反应的化学方程式为
(4)实验室在保存L溶液时,需加入少量D,理由是
(5)已知一定条件下,每1mol F与单质B完全反应生成I放出热量98.0kJ,若2mol F与1mol B在此条件下发生反应,达平衡时,放出热量为176.4kJ,则F的转化率为
①4mol F、2mol B ②2mol F、2mol B、2mol I
③1mol F、0.5mol B、1mol I ④3mol I、1mol Ne.
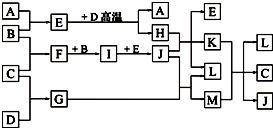
分析:甲元素原子核外电子数等于其电子层数,可能为H、Be、Al等元素,因甲对应的单质A为气体,则甲为H元素,A为H2,A与B反应生成的E常温下为液体,应为H2O,则B为O2,所以乙为O元素,乙、丙同主族,则丙为S元素,C为S单质,D为常见金属,可与水在高温下反应,则应为Fe,生成的黑色固体H为Fe3O4,由转化关系B+C→F
I可知,F为SO2,I为SO3,J为H2SO4,Fe和S反应生成的G为FeS,则L为FeSO4,M为H2S,K为Fe2(SO4)3,H2S与Fe2(SO4)3反应生成S、H2SO4和FeSO4,结合对应物质的性质以及题目要求解答该题.
| B |
解答:解:甲元素原子核外电子数等于其电子层数,可能为H、Be、Al等元素,因甲对应的单质A为气体,则甲为H元素,A为H2,A与B反应生成的E常温下为液体,应为H2O,则B为O2,所以乙为O元素,乙、丙同主族,则丙为S元素,C为S单质,D为常见金属,可与水在高温下反应,则应为Fe,生成的黑色固体H为Fe3O4,由转化关系B+C→F
I可知,F为SO2,I为SO3,J为H2SO4,Fe和S反应生成的G为FeS,则L为FeSO4,M为H2S,K为Fe2(SO4)3,H2S与Fe2(SO4)3反应生成S、H2SO4和FeSO4,
(1)E为H2O,M为H2S,O的非金属性较强,水分子之间存在氢键,沸点较高,故答案为:水分子之间存在氢键,故水的沸点高于H2S;
(2)甲、乙两种元素可以形成两种化合物,其中一种化合物含有4个原子核,应为H2O2,结构式为H-O-O-H,故答案为:H-O-O-H;
(3)E(H2O)与D(Fe)高温反应的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2,H2S与Fe2(SO4)3反应生成S、H2SO4和FeSO4,反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2;2Fe3++H2S=2Fe2++S↓+2H+;
(4)L为FeSO4,易被氧化,为防止Fe2+被氧化,可加入少量的Fe,实验室检验FeSO4水溶液中的阳离子的方法是取少许溶液于洁净的试管中,加入几滴KSCN溶液,无现象,再加入氯水溶液变血红色,则证明有Fe2+,
故答案为:防止Fe2+被氧化; 取少许溶液于洁净的试管中,加入几滴KSCN溶液,无现象,再加入氯水溶液变血红色,则证明有Fe2+;
(5)已知一定条件下,每1mol SO2与O2完全反应生成I放出热量98.0kJ,则2molSO2与O2完全反应生成I放出热量196.0kJ,
若2mol SO2与1mol O2在此条件下发生反应,达平衡时,放出热量为176.4kJ,则SO2的转化率为
×100%=90%,
若保持温度和压强不变(反应混合物都为气体),达到平衡时各物质的物质的量与上述平衡状态相同,应满足所加物质转化为起始物质,物质的量应满足2mol SO2与1mol O2,只有③符合,
故答案为:90%;③.
| B |
(1)E为H2O,M为H2S,O的非金属性较强,水分子之间存在氢键,沸点较高,故答案为:水分子之间存在氢键,故水的沸点高于H2S;
(2)甲、乙两种元素可以形成两种化合物,其中一种化合物含有4个原子核,应为H2O2,结构式为H-O-O-H,故答案为:H-O-O-H;
(3)E(H2O)与D(Fe)高温反应的化学方程式为3Fe+4H2O(g)
| ||
故答案为:3Fe+4H2O(g)
| ||
(4)L为FeSO4,易被氧化,为防止Fe2+被氧化,可加入少量的Fe,实验室检验FeSO4水溶液中的阳离子的方法是取少许溶液于洁净的试管中,加入几滴KSCN溶液,无现象,再加入氯水溶液变血红色,则证明有Fe2+,
故答案为:防止Fe2+被氧化; 取少许溶液于洁净的试管中,加入几滴KSCN溶液,无现象,再加入氯水溶液变血红色,则证明有Fe2+;
(5)已知一定条件下,每1mol SO2与O2完全反应生成I放出热量98.0kJ,则2molSO2与O2完全反应生成I放出热量196.0kJ,
若2mol SO2与1mol O2在此条件下发生反应,达平衡时,放出热量为176.4kJ,则SO2的转化率为
| 176.4 |
| 196 |
若保持温度和压强不变(反应混合物都为气体),达到平衡时各物质的物质的量与上述平衡状态相同,应满足所加物质转化为起始物质,物质的量应满足2mol SO2与1mol O2,只有③符合,
故答案为:90%;③.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,注意该题的突破口,以原子结构和物质的转化关系为题眼进行推断,难度中等,注意等效平衡问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
(2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
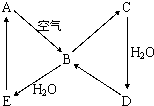 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.