网址:http://m.1010jiajiao.com/timu3_id_344517[举报]
(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g) 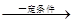 CO(g)+3H2(g)
I。
CO(g)+3H2(g)
I。
CH4的转化率与温度、压强的关系如图所示。
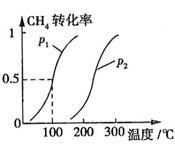
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的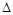 H
0。(填“<”、“>”或“=”)
H
0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g) 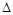 H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充人lmolCO和3 mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
|
实验编号 |
T(℃) |
n(CO)/n(H2) |
p(MPa) |
|
l |
150 |
1/3 |
0.1 |
|
2 |
n |
1/3 |
5 |
|
3 |
350 |
m |
5 |
a.上表中剩余的实验条件数据:n= ,m= 。
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强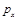 = MPa。
= MPa。
查看习题详情和答案>>

已知:


(1)写出A含有的官能团的名称


(2)D生成E的反应类型是
(3)A合成B的同时,A自身之间也能发生缩聚反应,写出该缩聚反应的化学方程式

| 一定条件 |
 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O(4)写出F与过量NaOH共热时反应的化学方程式


(5)B有多种同分异构体,写出符合下列条件的一种物质的结构简式
 或
或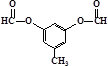
 或
或
①只有一种官能团 ②能发生银镜反应
③苯环上的一氯取代物只有二种 ④核磁共振谱共有四组峰,个数比为3:2:2:1.
(6)下列有关说法正确的是
A.可由A经一步反应获得D
B、
 与G互为同分异构体
与G互为同分异构体C.G易水解,可用FeCl3溶液检验是否发生水解
D.1molG一定能和5mol氢气反应.
完成下列计算:
(1)将4.6g金属钠投入100克水中,充分反应.已知:2Na+2H2O→2NaOH+H2↑
①生成标准状况下氢气
②求反应后溶液中NaOH的质量分数
(2)将10g CO和CO2的混合气体,通过装有足量过氧化钠的干燥管,反应后干燥管的总质量增加了5.6g.
已知:2Na2O2+2CO2→2Na2CO3+O2,求原混合气体中CO2的质量分数.计算过程:
(3)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O→Na2CO3?nH2O(n为平均值,n≤10).
取没有妥善保管已部分变质的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表.(不计溶于水的CO2气体)
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
Na2CO3+HCl→NaHCO3+NaCl NaHCO3+HCl→NaCl+CO2↑+H2O
试求:
①滴入稀盐酸的物质的量浓度为:
②当加入盐酸后,生成CO2体积不再增加时,x的最小值为
③部分变质后样品A中:NaHCO3的物质的量;Na2CO3?nH2O的物质的量以及n值.计算过程:
某芳香族化合物A式量小于150,氢氧质量比为1∶8,完全燃烧后只生成CO2和H2O。取等质量的A分别与足量NaHCO3和Na反应,生成的气体在同温同压下的体积比为1∶1。工业常用A来合成药物B及医药中间体G,流程如下:

已知:

(1)写出A含有的官能团的名称 ,D的结构简式 。
(2)D生成E的反应类型是 。
(3)A合成B的同时,A自身之间也能发生缩聚反应,写出该缩聚反应的化学方程式 。
(4)写出F与过量NaOH共热时反应的化学方程式 。
(5)B有多种同分异构体,写出符合下列条件的一种物质的结构简式 。
①只有一种官能团
②能发生银镜反应
③苯环上的一氯取代物只有二种
④核磁共振谱共有四组峰,个数比为3∶2∶2∶1。
(6)下列有关说法正确的是 。
A.可由A经一步反应获得D
B. 与G互为同分异构体
与G互为同分异构体
C.G易水解,可用FeCl3溶液检验是否发生水解
D.1molG一定能和5mol氢气反应
查看习题详情和答案>>
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象

(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。

浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液
 及电极均相同,两杯溶液的温度不同,可否形成原电池
及电极均相同,两杯溶液的温度不同,可否形成原电池3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池:表1
| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
电流 mA mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表
 面有铜析出。
面有铜析出。这说明:甲杯中的电极反应式为
乙杯中的电极反应式为

电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
查看习题详情和答案>>