摘要:30.53
网址:http://m.1010jiajiao.com/timu3_id_343985[举报]
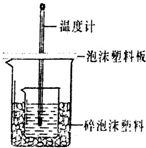 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.(1)该装置中缺少的一种仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
,装置中还存在的错误有大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎泡沫塑料
大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎泡沫塑料
;大烧杯杯口若不盖泡沫塑料板,测得中和热的数值将偏小
偏小
.(填“偏大”、“偏小”或“无影响”)(2)实验中,所用NaOH稍过量的原因是
确保定量的HCl反应完全
确保定量的HCl反应完全
.(3)在中和热测定实验中,有用水洗涤温度计上的盐酸溶液的步骤,若无此操作,则测得的中和热数值
偏小
偏小
(填“偏大”、“偏小”或“不变”).测量NaOH溶液温度时,温度计上的碱未用水冲洗,对测定结果有何影响?无影响
无影响
(填“偏大”、“偏小”或“无影响”).(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
-56.8 kJ/mol
-56.8 kJ/mol
.(保留到小数点后1位) 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为
46.1kJ
46.1kJ
;(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)
 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据:| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | 平衡常数 | |
| H2 | N2 | NH3 | |||
| 1 | 298 | 6 | 2 | 1.2 | 4.1×106 |
| 2 | 398 | 3 | 1 | 0.8 | K1 |
①反应的平衡常数表达式为
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
K1的相对大小,K1
<
<
4.1×106(填写“>”“=”或“<”);②实验1中以υ(H2) 表示的反应速率为
0.45mol/(L?min)
0.45mol/(L?min)
;③下列各项能作为判断该反应达到化学平衡状态的依据的是
C
C
(填序号字母);A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.υ(N2)(正)=3υ(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是
NH4++D2O NH3?HDO+D+
NH3?HDO+D+
 NH3?HDO+D+
NH3?HDO+D+NH4++D2O NH3?HDO+D+
NH3?HDO+D+
. NH3?HDO+D+
NH3?HDO+D+在宇宙飞船中,为了使宇航员得到良好的生存环境,一般在飞船机内安装了盛有Na2O2颗粒的装置,它的用途是再生O2,如果用KO2代替Na2O2也能达到同样的目的,反应产物也很相似.
(1)写出KO2与CO2反应的化学方程式
(2)计算用Na2O2和KO2分别与CO2反应,产生等量的氧气,所需Na2O2和KO2的质量比为
查看习题详情和答案>>
(1)写出KO2与CO2反应的化学方程式
4KO2+2CO2=2K2CO3+3O2
4KO2+2CO2=2K2CO3+3O2
;(2)计算用Na2O2和KO2分别与CO2反应,产生等量的氧气,所需Na2O2和KO2的质量比为
1.6
1.6
.(精确到小数点后的一位小数).