摘要:在1L/mol/L的氯水中 (A)含有1molNH3分子 (B)含有NH3和之和为1mol (C)含NH3·H2O1mol (D)含NH3.NH3·H2O.之和为1mol
网址:http://m.1010jiajiao.com/timu3_id_343679[举报]
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
(2)某同学取X的溶液,在空气中放置一段时间后用酸酸化,再加入KI淀粉溶液,发现溶液变为蓝色。写出与上述变化过程相关的离子方程式:
、 。
(3)写出Cl2将Z氧化为K2EO4的化学方程式: 。
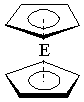 (4)由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境
(4)由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境
![]()
完全相同。但早期人们却错误地认为它的结构为: 。
核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构
有 种峰,错误的结构有 种峰。
(5)在1L 1mol/L的稀硝酸中加入0.3 mol金属E (还原产物只有NO),充分反应后,请简述检验溶液中的金属阳离子的实验操作及现象
查看习题详情和答案>>
(2010?朝阳区模拟)根据废水中所含有害物质的不同,工业上有多种废水的处理方法.
(1)①废水I若采用CO2处理,离子方程式是
②废水Ⅱ常用明矾处理.实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为
③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++
我国规定,Hg2+的排放标准不能超过0.05mg/L.若某工厂排放的废水1L中含Hg2+3×10-7mol,是否达到了排放标准
④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液.
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热.
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液 滴定.终点时消耗硫酸亚铁铵溶液V2 mL.
①I中,量取K2Cr207,溶液的仪器是
②Ⅱ中,碎瓷片的作用是
③Ⅲ中,发生的反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
(用含c、V1、V2的表达式表示).
查看习题详情和答案>>

(1)①废水I若采用CO2处理,离子方程式是
OH-+CO2=HCO3-
OH-+CO2=HCO3-
.②废水Ⅱ常用明矾处理.实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为
HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强
HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强
.③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++
CH4
CH4
═CH3Hg++H+我国规定,Hg2+的排放标准不能超过0.05mg/L.若某工厂排放的废水1L中含Hg2+3×10-7mol,是否达到了排放标准
否
否
(填“是”或“否”).④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为
5Cl2+2CN-+4H2O=10Cl-+2CO2+N2+8H+
5Cl2+2CN-+4H2O=10Cl-+2CO2+N2+8H+
.(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液.
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热.
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液 滴定.终点时消耗硫酸亚铁铵溶液V2 mL.
①I中,量取K2Cr207,溶液的仪器是
酸式滴定管(或移液管)
酸式滴定管(或移液管)
.②Ⅱ中,碎瓷片的作用是
防止暴沸
防止暴沸
.③Ⅲ中,发生的反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为
10%
10%
.若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议(写出一条即可)增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨)
增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨)
.(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
.(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
②试判断K1
>
>
K2(填写“>”“=”或“<”);③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
请计算NH3(g)的燃烧热
282.8kJ/mol
282.8kJ/mol
.在1L容积固定的密闭容器中进行A、B、C、D四种气体间的反应,容器内各物质的物质的量随时间的变化如下表:
根据以上信息回答下列问题:
(1)该反应的化学方程式为: ;
(2)反应到第2min时,用B表示的平均反应速率为 mol?L-1?min-1;
(3)反应到第3min时,A物质的转化率为 ;
(4)实验表明升高温度该反应的平衡常数K值会减小,则该反应为 反应(填“放热”或“吸热”),在第4min时改变了某一条件,该条件可能是 ;
A.升温 B.增加B的浓度 C.使用催化剂 D.通入稀有气体
(5)下列能说明该反应达到平衡状态的是 .
A.反应停止了 B.2v(B)消耗=v(C)消耗
C.体系的密度保持不变 D.体系的压强保持不变.
查看习题详情和答案>>
| 时间/物质的量 | n(A)(mol) | n(B)(mol) | n(C)(mol) | n(D)(mol) |
| 起始 | 0.9 | 1.4 | 0 | 0.2 |
| 第1min | 0.6 | 1.1 | 0.15 | |
| 第2min | 0.4 | 0.9 | 0.25 | |
| 第3min | 0.3 | 0.8 | 0.8 | |
| 第4min | 0.3 | 0.8 | 0.3 | 0.8 |
| 第5min | 0.35 | 0.85 | 0.275 | 0.75 |
(1)该反应的化学方程式为:
(2)反应到第2min时,用B表示的平均反应速率为
(3)反应到第3min时,A物质的转化率为
(4)实验表明升高温度该反应的平衡常数K值会减小,则该反应为
A.升温 B.增加B的浓度 C.使用催化剂 D.通入稀有气体
(5)下列能说明该反应达到平衡状态的是
A.反应停止了 B.2v(B)消耗=v(C)消耗
C.体系的密度保持不变 D.体系的压强保持不变.