网址:http://m.1010jiajiao.com/timu3_id_342507[举报]
(07年理综北京卷?8)X、Y为短周期元素,X位于I A族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
查看习题详情和答案>>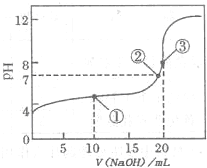 (2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.
(2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是
(2)判断HX是
(3)点①所示溶液中,各离子浓度由大到小的顺序是
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
| 实验 | 样品体积/mL | 高锰酸钾溶液体积/mL |
| 1 | 10.00 | 8.98 |
| 2 | 10.00 | 8.58 |
| 3 | 10.00 | 9.02 |
| 4 | 10.00 | 9.00 |
(2)写出滴定时所发生反应的离子方程式
(3)计算样品中钙的含量
(4)下列操作会使测量结果偏低的是
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.
(12分)(2009·山东理综)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___ _____________________________________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn
c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
(A)“物质结构与性质”课程模块
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是___________ (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是________;③和⑦形成的常见化合物的化学键类型是___________。
(3)元素⑧的外围电子排布式为___________,该元素原子中未成对电子数为___________。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_________________________________________________。
(5)在1 183 K以下,元素⑨形成如图甲所示基本结构单元的晶体;1 183 K以上,转变为图乙所示基本结构单元的晶体。

在1 183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为___________;在1 183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为___________。
(B)“实验化学”课程模块
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:

氧化型(蓝色)+ne-![]() 还原型(无色)。
还原型(无色)。
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图甲。
某校化学兴趣小组用图甲装置进行下述实验:
①在250 mL锥形瓶中,依次加入
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③④可重复多次。
请回答下列问题:
(1)若塞紧图甲中锥形瓶塞,并打开导管活塞a、b,从___________(填“左”或“右”)导管口通入足量氦气后,再关闭活塞a、b并振荡,溶液__________(填“能”或“不能”)由无色变为蓝色。
(2)如图乙所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是___________试管。
(3)上述转化过程中葡萄糖的作用是_______________,亚甲基蓝的作用是______________。
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为______________。
(5)该实验中③④操作___________(填“能”或“不能”)无限次重复进行,理由是____________。
查看习题详情和答案>>(9分)某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究。
(1)实验室制取氨气的化学方程式为 。
(2)某同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(3)该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。
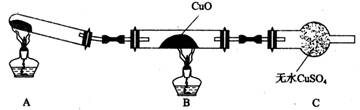
①该装置在设计上有一定缺陷。为保证实验结果的准确性,对该装置的改进措施是
。
②利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。氨气与CuO反应的化学方程式为 。
③有同学认为NH3与CuO反应生成的红色物质中可能含Cu2O。Cu2O在酸性溶液中Cu+歧化生成Cu和Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O
。
查看习题详情和答案>>