题目内容
 (2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.
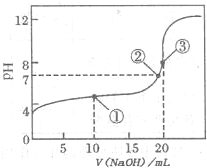
(2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是
500mL容量瓶
500mL容量瓶
.(2)判断HX是
弱酸
弱酸
(填“强酸”或“弱酸”),理由是当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000mol?L-1HX的pH大于1
当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000mol?L-1HX的pH大于1
(3)点①所示溶液中,各离子浓度由大到小的顺序是
c(X-)>c(Na+)>c(H+)>c(OH-)
c(X-)>c(Na+)>c(H+)>c(OH-)
.II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
| 实验 | 样品体积/mL | 高锰酸钾溶液体积/mL |
| 1 | 10.00 | 8.98 |
| 2 | 10.00 | 8.58 |
| 3 | 10.00 | 9.02 |
| 4 | 10.00 | 9.00 |
当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色
当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色
.(2)写出滴定时所发生反应的离子方程式
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
.(3)计算样品中钙的含量
9.00
9.00
g/L.(4)下列操作会使测量结果偏低的是
b、d
b、d
.a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.
分析:Ⅰ:(1)配制溶液时一定用到容量瓶,体积应和待配溶液体积相接近;
(2)0.1000mol?L-1一元酸HX溶液的PH>1,应为弱酸;
(3)点①所示溶液中,酸过量,溶液呈酸性,
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变;
(2)根据高锰酸钾与草酸发生氧化还原反应书写反应的离子方程式;
(3)根据5CaC2O4~5H2C2O4~2MnO4-计算;
(4)根据关系式c(待测)×V(待测)=c(标准)×V(标准).
(2)0.1000mol?L-1一元酸HX溶液的PH>1,应为弱酸;
(3)点①所示溶液中,酸过量,溶液呈酸性,
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变;
(2)根据高锰酸钾与草酸发生氧化还原反应书写反应的离子方程式;
(3)根据5CaC2O4~5H2C2O4~2MnO4-计算;
(4)根据关系式c(待测)×V(待测)=c(标准)×V(标准).
解答:解:Ⅰ:(1)配制溶液时一定用到容量瓶,实验需用约400mL,应用500mL容量瓶,故答案为:500mL容量瓶;
(2)酸的浓度为0.1000 mol?L-1,由图象可以看出0.1000mol?L-1一元酸HX溶液的PH>1,当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,都可以说明HX为弱酸,
故答案为:弱酸;当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000 mol?L-1 HX的pH大于1;
(3)点①所示溶液中,酸过量,溶液呈酸性,则溶液中存在c(H+)>c(OH-),
根据溶液电中性:c(H+)+c(Na+)=c(X-)+c(OH-),则c(X-)>c(Na+),且c(Na+)>c(H+),
故有c(X-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(X-)>c(Na+)>c(H+)>c(OH-);
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变,该反应中当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,
故答案为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色;
(2)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(3)第2组数据误差较大,舍去,根据其它三组数据计算,高锰酸钾溶液的平均体积为:
mL=9.00mL,
5CaC2O4~5H2C2O4~2MnO4-
5mol 5mol 2mol
n 0.1mol/L×9×10-3L
n=2.25×10-3mol,
则m(Ca2+)=2.25×10-3mol×40g/mol=0.09g,
所以1L样品中含有0.09g×
=9.00g,
故答案为:9.00;
(4)a.滴定前俯视读数,滴定后仰视读数,会导致体积偏大,测量结果偏大,故a错误;
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外,会导致所需标准液偏小,故b正确;
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故c错误;
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体,会导致所需标准液偏小,故d正确.
故答案为:b、d.
(2)酸的浓度为0.1000 mol?L-1,由图象可以看出0.1000mol?L-1一元酸HX溶液的PH>1,当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,都可以说明HX为弱酸,
故答案为:弱酸;当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000 mol?L-1 HX的pH大于1;
(3)点①所示溶液中,酸过量,溶液呈酸性,则溶液中存在c(H+)>c(OH-),
根据溶液电中性:c(H+)+c(Na+)=c(X-)+c(OH-),则c(X-)>c(Na+),且c(Na+)>c(H+),
故有c(X-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(X-)>c(Na+)>c(H+)>c(OH-);
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变,该反应中当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,
故答案为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色;
(2)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(3)第2组数据误差较大,舍去,根据其它三组数据计算,高锰酸钾溶液的平均体积为:
| 8.98+9.02+9.00 |
| 3 |
5CaC2O4~5H2C2O4~2MnO4-
5mol 5mol 2mol
n 0.1mol/L×9×10-3L
n=2.25×10-3mol,
则m(Ca2+)=2.25×10-3mol×40g/mol=0.09g,
所以1L样品中含有0.09g×
| 1000mL |
| 10mL |
故答案为:9.00;
(4)a.滴定前俯视读数,滴定后仰视读数,会导致体积偏大,测量结果偏大,故a错误;
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外,会导致所需标准液偏小,故b正确;
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故c错误;
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体,会导致所需标准液偏小,故d正确.
故答案为:b、d.
点评:本题考查酸碱中和滴定,题目难度中等,注意把握滴定原理以及实验的误差分析,为该题的易错点.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
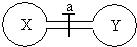 (2011?巢湖二模)常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是( )
(2011?巢湖二模)常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是( )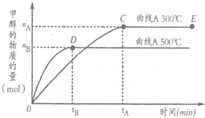 (2011?巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(2011?巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),结合右图判断下列说法正确的是( )
CH3OH(g),结合右图判断下列说法正确的是( ) (2011?巢湖二模)下列说法正确的是( )
(2011?巢湖二模)下列说法正确的是( )