摘要: (1) C; O; Na; S; Cl (2) 略 (3)2Na2O2 + 2CO2 = 2Na2CO3 + O2
网址:http://m.1010jiajiao.com/timu3_id_342330[举报]
[化学--物质结构与性质]
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
(1)写出D原子的外围电子排布式
(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点
(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
在A和O之间通过双键形成AO2分子,而F和O则不能和A那样形成有限分子,原因是
(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.


则在以上分子中,中心原子采用sp3杂化形成化学键的是
(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B4(g)═2B2(g)△H=
查看习题详情和答案>>
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
3d104s1
3d104s1
,A、B、C、D四种元素的第一电离能最小的是Cu
Cu
(用元素符号表示).(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点
高
高
(填“高”或“低”).(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
C=O的键能比C-O的键能的两倍要大,Si=O的键能比Si-O的键能的两倍要小,所以Si和O成单键更稳定,而C和O以双键形成稳定分子
C=O的键能比C-O的键能的两倍要大,Si=O的键能比Si-O的键能的两倍要小,所以Si和O成单键更稳定,而C和O以双键形成稳定分子
.(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是
ce
ce
(填序号).a.离子键 b.极性键c.非极性键d.配位键 e.金属键(5)下列分子结构图中的“
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
①③
①③
(填序号);在②的分子中有3
3
个σ键和2
2
个π键.(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B4(g)═2B2(g)△H=
-(2b-6a)
-(2b-6a)
KJ/mol.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白.
(1)在这些元素中化学性质最不活泼的是
(2)①②⑥⑦中原子半径最小的是
(3)表中氧化性最强的单质的化学式为
(4)这些元素的最高价氧化物的水化物中,碱性最强的是
(5)⑥⑦两种元素中,离子半径较小的是
(6)④⑧⑨三种元素的气态氢化物的稳定性强弱顺序为
(7)①与③形成的化合物中,固态时俗称干冰的结构式
(8)画出⑨的原子结构示意图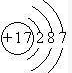
 .
.
(9)元素②的氢化物与元素⑨的氢化物反应的化学方程式为
查看习题详情和答案>>
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
Ne
Ne
(填元素符号)(2)①②⑥⑦中原子半径最小的是
N
N
(填元素符号);(3)表中氧化性最强的单质的化学式为
F2
F2
;(4)这些元素的最高价氧化物的水化物中,碱性最强的是
NaOH
NaOH
(填化学式);(5)⑥⑦两种元素中,离子半径较小的是
Al3+
Al3+
(填离子符号);(6)④⑧⑨三种元素的气态氢化物的稳定性强弱顺序为
HF
HF
>HCl
HCl
>H2S
H2S
(填化学式);(7)①与③形成的化合物中,固态时俗称干冰的结构式
O=C=O
O=C=O
,该化合物属于共价
共价
(填“共价”或“离子”)化合物.(8)画出⑨的原子结构示意图


(9)元素②的氢化物与元素⑨的氢化物反应的化学方程式为
NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
;该反应的产物属于离子
离子
(填“共价”或“离子”)化合物. 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:(1)“O”点导电能力为0的理由是
在“O”点处醋酸未电离,无离子存在
在“O”点处醋酸未电离,无离子存在
;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为
c<a<b
c<a<b
;(3)a、b、c三点处,电离程度最大的是
c
c
;(4)若使c(CH3COO-)增大,溶液c(H+)减小,可采取的措施是:①
加少量NaOH固体
加少量NaOH固体
;②加少量Na2CO3固体
加少量Na2CO3固体
;③加入Zn、Mg等金属
加入Zn、Mg等金属
.有下列六种固体物质:①氯化镁、②金刚石、③白磷、④过氧化钠、⑤干冰、⑥二氧化硅,请回答有关这六种固体物质的问题.
(1)将这六种固体按不同晶体类型分成三组,并填写下表:
(2)其中以共价键相结合,原子彼此间形成空间网状结构的化合物是
(3)其中硬度最大的物质是
(4)请写出氯化镁的电子式
 ,干冰的结构式
,干冰的结构式
查看习题详情和答案>>
(1)将这六种固体按不同晶体类型分成三组,并填写下表:
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 |
| 各组中物质的编号 |
⑥
⑥
(填编号).晶体内存在分子的单质是③
③
(填编号).含有共价键的离子化合物是④
④
;(3)其中硬度最大的物质是
②
②
(填编号);熔点最低的物质是⑤
⑤
(填编号).(4)请写出氯化镁的电子式


O=C=O
O=C=O
.(2011?崇明县一模)在元素周期表中,相邻近的元素在结构和性质上有相似之处.
(1)例如:第二周期的Be与第三周期Al.
①Al原子的最外层电子排布式为
②Be 的氧化物的化学式为
(2)物质的化学键键能是指气态原子间形成1mol化学键释放的能量,如H(g)+I(g)→H-I(g)+297kJ H-I的键能为297kJ/mol,也可以理解为破开1mol H-I 键需要吸收297kJ的热量.下表是一些键能数据
根据表中数据回答下列问题:
①判断CCl4的稳定性
②卤代烃在同样条件下发生碱性水解时,RF、RCl、RBr、RI(R为相同的烃基)反应活性由大到小的顺序的是
③下列关于水和硫化氢的讨论正确的是
查看习题详情和答案>>
(1)例如:第二周期的Be与第三周期Al.
①Al原子的最外层电子排布式为
3s23p1
3s23p1
,其最高价氧化物对应的水化物在碱性溶液中的电离方程式为Al(OH)3?AlO2-+H++H2O
Al(OH)3?AlO2-+H++H2O
.②Be 的氧化物的化学式为
BeO
BeO
,其最高价氧化物对应的水化物分别与足量NaOH溶液和盐酸反应的化学方程式为Be(OH)2+2NaOH=Na2BeO2+H2O
Be(OH)2+2NaOH=Na2BeO2+H2O
、Be(OH)2+2HCl=BeCl2+H2O
Be(OH)2+2HCl=BeCl2+H2O
.(2)物质的化学键键能是指气态原子间形成1mol化学键释放的能量,如H(g)+I(g)→H-I(g)+297kJ H-I的键能为297kJ/mol,也可以理解为破开1mol H-I 键需要吸收297kJ的热量.下表是一些键能数据
| 键能(kJ/mol) | 键能(kJ/mol) | 键能(kJ/mol) | |||
| H-H | 436 | C-Cl | 243 | H-Cl | 432 |
| Cl-Cl | 330 | C-I | 218 | C-F | 427 |
| C-O | 347 | H-O | 464 | H-F | 565 |
①判断CCl4的稳定性
小于
小于
(填“大于”或“小于”)CF4 的稳定性.②卤代烃在同样条件下发生碱性水解时,RF、RCl、RBr、RI(R为相同的烃基)反应活性由大到小的顺序的是
RI>RBr>RCl>RF
RI>RBr>RCl>RF
.③下列关于水和硫化氢的讨论正确的是
C
C
(填编号)| 选项 | 现象:沸点H2O>H2S | 原理:键能H-O>H-S | 原理对现象的解释 |
| A | 正确 | 正确 | 可以 |
| B | 错误 | 正确 | |
| C | 正确 | 错误 | |
| D | 正确 | 正确 | 不可以 |