摘要: (1) . (4) 第一学期 高三年级第三次考试化学试卷
网址:http://m.1010jiajiao.com/timu3_id_342013[举报]
 化合物A经李比希法测得其中含C72.0%、H 6.67%,其余含有氧,质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.
化合物A经李比希法测得其中含C72.0%、H 6.67%,其余含有氧,质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.方法一:核磁共振仪可以测定有机分子里不同化学环境的氢原子及其相对数量.如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比3﹕2﹕1,见如图所示.现测出A的核磁共振氢谱有5个峰,其面积之比为1﹕2﹕2﹕2﹕3.
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图.己知A分子中只含一个苯环,且苯环上只有一个取代基,试填空:

(1)A的分子式为
C9H10O2
C9H10O2
,结构简式为 (或
(或 或
或 )
) (或
(或 或
或 )
)(2)A的芳香类同分异构体有多种,请按要求写出其中两种:①分子中不含甲基的芳香酸:




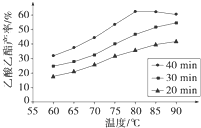 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃.在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示.(1)该研究小组的实验目的是
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
Ⅱ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)??H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C(s)+H2O(g)??CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2O(g)??H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是
(3)在V L密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2 842kJ(已知CO燃烧热为283kJ?mol-1,H2燃烧热为286kJ?mol-1),则T℃平衡常数K=
重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等.以铬矿石(主要成分为Cr2O3,还含有FeO、A12O3、SiO2等杂质)为原料制取重铬酸钠的流程如图1:

(1)Cr2O3在高温焙烧时反应的化学方程式为
(2)生产过程中,调节pH的目的是使SiO32-、AlO2-分别转化为
(3)图2是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线:
上述提纯过程中,去除杂质Na2SO4的实验方法:将Na2Cr2O7和Na2SO4混合溶液加热浓缩,然后
(4)某化工厂改进工艺,采用原理如图3所示的装置(电极为石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转化为Na2Cr2O7.写出阳极的电极方程式
(5)根据国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol?L-1以下才能排放.处理废水的常用方法为:向废水中加入可溶性钡盐生成BaCrO4沉淀,再加入某种试剂处理多余的Ba2+.[已知:Ksp(BaCrO4)=1.2×10-10]
①从物质分类的角度看,除去多余的Ba2+离子,所加的试剂类型为
②加入可溶性钡盐后,废水中Ba2+的浓度应不小于
查看习题详情和答案>>

(1)Cr2O3在高温焙烧时反应的化学方程式为
2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2
| ||
2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2
.
| ||
(2)生产过程中,调节pH的目的是使SiO32-、AlO2-分别转化为
H2SiO3
H2SiO3
、Al(OH)3
Al(OH)3
(填写化学式).(3)图2是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线:
上述提纯过程中,去除杂质Na2SO4的实验方法:将Na2Cr2O7和Na2SO4混合溶液加热浓缩,然后
趁热过滤
趁热过滤
,可得到Na2SO4固体和较纯净的Na2Cr2O7溶液.(4)某化工厂改进工艺,采用原理如图3所示的装置(电极为石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转化为Na2Cr2O7.写出阳极的电极方程式
2H2O-4e-=O2+4H+
2H2O-4e-=O2+4H+
.(5)根据国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol?L-1以下才能排放.处理废水的常用方法为:向废水中加入可溶性钡盐生成BaCrO4沉淀,再加入某种试剂处理多余的Ba2+.[已知:Ksp(BaCrO4)=1.2×10-10]
①从物质分类的角度看,除去多余的Ba2+离子,所加的试剂类型为
硫酸盐
硫酸盐
.②加入可溶性钡盐后,废水中Ba2+的浓度应不小于
2.4×10-4mol?L-1
2.4×10-4mol?L-1
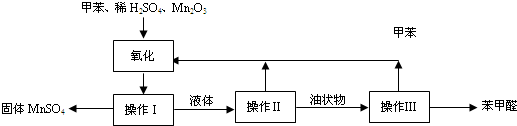
.(2011?奉贤区一模)苯甲醛在医药、染料、香料等工业有广泛的应用.实验室通过如图所示的操作流程可制备苯甲醛:
试回答下列问题:
(1)此反应中氧化剂是
(2)操作I需经三步才能完成:第一步为冷却结晶,第二步为
(3)操作II的名称为
(4)操作Ⅲ的原理是
(5)实验过程中,可以循环使用的物质是
(6)实验中发现,反应时间不同,苯甲醛的产率也不同(数据见表)
请结合苯甲醛的结构特点,分析当反应时间过长时,其产率下降的原因:
查看习题详情和答案>>

试回答下列问题:
(1)此反应中氧化剂是
Mn2O3
Mn2O3
,稀硫酸的作用是形成酸性环境或增大Mn2O3的氧化性
形成酸性环境或增大Mn2O3的氧化性
.(2)操作I需经三步才能完成:第一步为冷却结晶,第二步为
过滤
过滤
,第三步为洗涤;其中冷却的目的是降低MnSO4的溶解度
降低MnSO4的溶解度
;第二步需用到的玻璃仪器为漏斗、玻璃棒、烧杯
漏斗、玻璃棒、烧杯
.(3)操作II的名称为
分液
分液
,该操作主要适用于分离两种互不相溶的液体
分离两种互不相溶的液体
.(4)操作Ⅲ的原理是
利用被分离物质的沸点不同,通过加热冷凝达到分离目的
利用被分离物质的沸点不同,通过加热冷凝达到分离目的
.(5)实验过程中,可以循环使用的物质是
稀硫酸、甲苯
稀硫酸、甲苯
.(6)实验中发现,反应时间不同,苯甲醛的产率也不同(数据见表)
| 反应时间(h) | 1 | 2 | 3 | 4 | 5 |
| 苯甲醛产率(%) | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
随着时间的延长,苯甲醛有部分被氧化成苯甲酸
随着时间的延长,苯甲醛有部分被氧化成苯甲酸
.