网址:http://m.1010jiajiao.com/timu3_id_341767[举报]
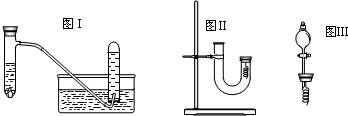
(1)写出试管内溶液中发生反应的化学方程式
(2)在实验过程中观察到试管内的溶液呈
(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
有关化学方程式为:
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L

请填写下列空白:
(1)已知0.5mol甲烷和0.5mol水蒸气在t℃,p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量.该反应的热化学方程式是:
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气请应用化学反应速率和化学平衡的观点说明采取该措施的理由:
(3)当甲烷合成氨气的转化率为75%时,以5.60×107L甲烷为原料能够合成
(4)已知尿素的结构简式为
 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①


(1)在19世纪时,铝是一种珍贵的金属.人们最初得到的铝粒如同珍宝,它的价格同黄金相当.1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝.用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是
(2)冶炼金属铝,第一步先出氧化铝制备无水氯化铝.已知:

2Al(s)+3Cl2(g)═2AlCl3(s)△H=-1390.8kJ/mol
4Al(s)+3O2(g)═2Al2O3(s)△H=-3339.6kJ/mol
2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
AlCl3(s)═AlCl3(g)△H=+akJ/mol(a>0)
则Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g)的△H=
(3)LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,写出该反应的化学方程式
(4)铝电池性能优越,铝--空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.该电池的总反应化学方程式为
(28分)
[1]由碳、氢、氧三种元素组成的某有机物分子中共含有13个原子,其原子核外共有40个电子,l mol该有机物在氧气中完全燃烧时需消耗5.5 mol O2。请回答:
(1)试求出该有机物的分子式为 。
(2)若该有机物可使溴水褪色,且分子中不含有甲基,也不能发生银镜反应,取0.1 mol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
(3)若该有机物能发生银镜反应,且分子中只含有一个甲基,则其结构简式是 。
(4)若该有机物的结构呈环状,且既不含甲基又不含羟基,则其键线式是 。
|
溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强
的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式 。
(3)下列有关“亮菌甲素”的叙述正确的是 (填序号)。
A.“亮菌甲素”能与H2发生加成反应 B.不能使酸性KMnO4退色
C.“亮菌甲素”分子中含氧官能团只有2种 D.1mol“亮菌甲素”最多与2molNaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个肿收峰,其峰面积之比为2:2:1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2。写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式
查看习题详情和答案>>
(12分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3―→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平,不考虑2NO2??N2O4)。
(1)硝酸在该反应中体现的性质是________。
(2)0.004 mol Cu被硝酸完全溶解后,Cu失去的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________;所得溶液(假设溶质不扩散)的物质的量浓度是________。
(3)如果参加反应的Cu和HNO3的物质的量之比是3∶10,写出并配平该反应的离子方程式______________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________________________。
查看习题详情和答案>>
