题目内容
铝是地壳中含量最高的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
(1)在19世纪时,铝是一种珍贵的金属.人们最初得到的铝粒如同珍宝,它的价格同黄金相当.1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝.用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是 .
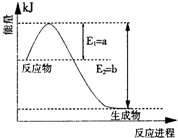
(2)冶炼金属铝,第一步先出氧化铝制备无水氯化铝.已知: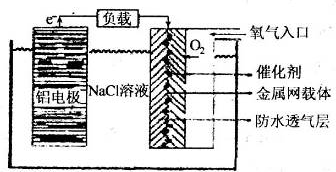
2Al(s)+3Cl2(g)═2AlCl3(s)△H=-1390.8kJ/mol
4Al(s)+3O2(g)═2Al2O3(s)△H=-3339.6kJ/mol
2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
AlCl3(s)═AlCl3(g)△H=+akJ/mol(a>0)
则Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g)的△H= kJ/mol
(3)LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,写出该反应的化学方程式 ;LiAlH4与乙醛作用生成乙醇,在该反应中LiAlH4作 剂.(填“氧化”或“还原”)
(4)铝电池性能优越,铝--空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.该电池的总反应化学方程式为 ;电池中NaCl的作用是 .以该电池为电源,用惰性电极电解100g 8%的Na2SO4溶液,当电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在标准状况下的体积共为 L.
(1)在19世纪时,铝是一种珍贵的金属.人们最初得到的铝粒如同珍宝,它的价格同黄金相当.1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝.用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是
(2)冶炼金属铝,第一步先出氧化铝制备无水氯化铝.已知:

2Al(s)+3Cl2(g)═2AlCl3(s)△H=-1390.8kJ/mol
4Al(s)+3O2(g)═2Al2O3(s)△H=-3339.6kJ/mol
2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
AlCl3(s)═AlCl3(g)△H=+akJ/mol(a>0)
则Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g)的△H=
(3)LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,写出该反应的化学方程式
(4)铝电池性能优越,铝--空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.该电池的总反应化学方程式为
分析:(1)钾性质较活泼,和水反应生成氢氧化钾和氢气,氢氧化钾能和氯化铝发生复分解反应;
(2)根据盖斯定律计算;
(3)LiAlH4和水反应生成LiAlO2和氢气,根据元素化合价变化判断;
(4)该原电池中,负极上铝失电子发生氧化反应,正极上氧气得电子发生还原反应,据此书写其电池反应式;溶液的导电性与溶液中自由离子浓度成正比;
电解硫酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,根据质量分数计算溶液中减少水的质量,再根据水和生成气体之间的关系式计算生成气体体积.
(2)根据盖斯定律计算;
(3)LiAlH4和水反应生成LiAlO2和氢气,根据元素化合价变化判断;
(4)该原电池中,负极上铝失电子发生氧化反应,正极上氧气得电子发生还原反应,据此书写其电池反应式;溶液的导电性与溶液中自由离子浓度成正比;
电解硫酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,根据质量分数计算溶液中减少水的质量,再根据水和生成气体之间的关系式计算生成气体体积.
解答:解:(1)钾是活泼金属,能和水反应生成氢氧化钾和氢气,氢氧化钾再和氯化铝溶液反应生成氢氧化铝,从而无法得到单质铝,
故答案为:钾先和水反应生成氢氧化钾,氢氧化钾再与氯化铝反应生成氢氧化铝,无法得到单质铝;
(2)2Al(s)+3Cl2(g)═2AlCl3(s)△H=-1390.8kJ/mol ①
4Al(s)+3O2(g)═2Al2O3(s)△H=-3339.6kJ/mol ②
2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol③
AlCl3(s)═AlCl3(g)△H=+akJ/mol(a>0)④
将方程式
②+①+
③+2④得Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g),
△H=
(-3339.6kJ/mol )+(-1390.8kJ/mol )+
(-221.0kJ/mol)+2(+akJ/mol)=(-52.5+2a)kJ/mol,
故答案为:-52.5+2a;
(3)LiAlH4和水反应生成LiAlO2和氢气,反应方程式为:LiAlH4+2H2O=LiAlO2+4H2↑,LiAlH4与乙醛作用生成乙醇,碳元素的化合价由-1价变为-2价,则乙醛作氧化剂,LiAlH4中氢元素的化合价由-1价变为+1价,所以在该反应中LiAlH4作还原剂,
故答案为:LiAlH4+2H2O=LiAlO2+4H2↑;还原剂;
(4)该原电池中,负极上铝失电子发生氧化反应,正极上氧气得电子发生还原反应,铝离子和氢氧根离子反应生成氢氧化铝,所以电池方程式为:4Al+3O2+6H2O=4Al(OH)3,
为了增大溶液的导电性且又不对其电池反应式造成影响而选择氯化钠,
电解硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实质上是电解水,100g 8%的Na2SO4溶液中硫酸钠的质量=100g×8%=8g,当电解到溶质的质量分数为12.5%时停止电解,此时溶液的质量=
=64g,所以电解水的质量=100g-64g=36g,水的物质的量=
=2mol,根据原子守恒知,电解2molg水生成2mol氢气和1mol氧气,则生成气体体积=3mol×22.4L/mol=67.2L,
故答案为:4Al+3O2+6H2O=4Al(OH)3;增强溶液的导电能力;67.2.
故答案为:钾先和水反应生成氢氧化钾,氢氧化钾再与氯化铝反应生成氢氧化铝,无法得到单质铝;
(2)2Al(s)+3Cl2(g)═2AlCl3(s)△H=-1390.8kJ/mol ①
4Al(s)+3O2(g)═2Al2O3(s)△H=-3339.6kJ/mol ②
2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol③
AlCl3(s)═AlCl3(g)△H=+akJ/mol(a>0)④
将方程式
| 1 |
| 2 |
| 3 |
| 2 |
△H=
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:-52.5+2a;
(3)LiAlH4和水反应生成LiAlO2和氢气,反应方程式为:LiAlH4+2H2O=LiAlO2+4H2↑,LiAlH4与乙醛作用生成乙醇,碳元素的化合价由-1价变为-2价,则乙醛作氧化剂,LiAlH4中氢元素的化合价由-1价变为+1价,所以在该反应中LiAlH4作还原剂,
故答案为:LiAlH4+2H2O=LiAlO2+4H2↑;还原剂;
(4)该原电池中,负极上铝失电子发生氧化反应,正极上氧气得电子发生还原反应,铝离子和氢氧根离子反应生成氢氧化铝,所以电池方程式为:4Al+3O2+6H2O=4Al(OH)3,
为了增大溶液的导电性且又不对其电池反应式造成影响而选择氯化钠,
电解硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实质上是电解水,100g 8%的Na2SO4溶液中硫酸钠的质量=100g×8%=8g,当电解到溶质的质量分数为12.5%时停止电解,此时溶液的质量=
| 8g |
| 12.5% |
| 36g |
| 18g/mol |
故答案为:4Al+3O2+6H2O=4Al(OH)3;增强溶液的导电能力;67.2.
点评:本题涉及氧化还原反应、电解池和原电池原理、盖斯定律等知识点,是一道小型综合题,根据各个电极上发生的反应来分析原电池和电解池,难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目

 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.