网址:http://m.1010jiajiao.com/timu3_id_340684[举报]
根据上述材料,回答下列问题:
(1)H2O2的结构式为________,分子中氧元素的化合价为 ________。
(2)H2O2的结构特点决定了H2O2具有多重性质。
①双氧水有多种性质:Na2O2+2HCl===H2O2+2NaCl,这个反应体现了双氧水的________性。
②向含有酚酞的NaOH溶液中滴加H2O2,溶液红色褪去,体现了H2O2的________性。
③将H2O2加入经酸化的KMnO4溶液中,溶液的紫红色消失,这体现了H2O2的________性
(3)H2O2被称为绿色氧化剂的理由是____________________________。
(4)下列物质不会使过碳酸钠失效的是________(填写字母序号)。
A.MnO2 B. H2S C.CH3COOH D. NaHCO3
(5)H2O2不稳定,易分解,在催化剂作用下分解更快。
①实验室用H2O2制O2的化学方程式为:_______________________________。
②已知下列反应在一定条件下可以发生:
a.H2O2+2Fe2++2H+===2Fe3++2H2O; b.H2O2+2Fe3+===2Fe2++O2↑+2H+;在以上反应中Fe2+实际上起着________作用,总反应式为__________________________。
[Ⅰ] 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验由废铁屑(含Fe2O3)制备FeSO4·7H2O晶体过程如下: (铁屑先用Na2CO3溶液洗涤去除了油污)
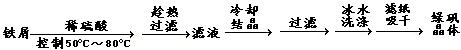
(1)铁屑溶解时发生主要反应的离子方程式____________________________
(2)有关制备中的分析错误的是_______
①铁屑需过量放可除去产生的Fe3+且利于防止产生Fe3+;②趁热过滤目的是加快过滤速度;③硫酸过稀致使溶液浓度过低不利于晶体大量析出;④冰水洗涤能减少晶体的溶解损失;⑤控制温度50)C~80)C利于制成饱和溶液,加速铁屑的溶解;
(3)检验滤液中是否含有的Fe3+方法是_____________________________________
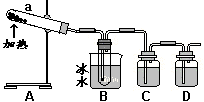 [Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O
[Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O![]() Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和SO2。
(4)① 试管b中得到的主要产物是___________,
② 为检验SO2生成物,试管c中应加入的试剂
是__________
③ B中所得硫酸的理论浓度(溶质的质量分数)为_________
(5)这一古老的制备方法被淘汰,除原料有限和能耗较高还可能原因有____________
查看习题详情和答案>>
|
下列关于由大豆制豆腐的过程说法正确的是 | |
A. |
先由大豆制成豆腐,再把豆浆加热浓缩就得豆腐 |
B. |
先由大豆制成豆浆,再在豆浆中加入凝固剂,使大豆蛋白质发生胶体聚沉而制成豆腐 |
C. |
制豆腐前,经过精选的大豆,必须要加水浸泡 |
D. |
制豆腐前,经过精选的大豆,可不必加水浸泡,直接与水一起进行磨浆处理即可 |