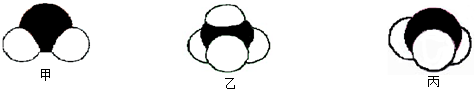
题目内容
[Ⅰ] 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验由废铁屑(含Fe2O3)制备FeSO4·7H2O晶体过程如下: (铁屑先用Na2CO3溶液洗涤去除了油污)
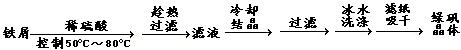
(1)铁屑溶解时发生主要反应的离子方程式____________________________
(2)有关制备中的分析错误的是_______
①铁屑需过量放可除去产生的Fe3+且利于防止产生Fe3+;②趁热过滤目的是加快过滤速度;③硫酸过稀致使溶液浓度过低不利于晶体大量析出;④冰水洗涤能减少晶体的溶解损失;⑤控制温度50)C~80)C利于制成饱和溶液,加速铁屑的溶解;
(3)检验滤液中是否含有的Fe3+方法是_____________________________________
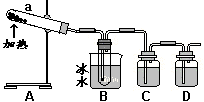 [Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O
[Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O![]() Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和SO2。
(4)① 试管b中得到的主要产物是___________,
② 为检验SO2生成物,试管c中应加入的试剂
是__________
③ B中所得硫酸的理论浓度(溶质的质量分数)为_________
(5)这一古老的制备方法被淘汰,除原料有限和能耗较高还可能原因有____________
(1)Fe+2H+=Fe2++H2;……(3分);(2)②……(3分);
(3)取少量冷却后溶液滴入几滴KSCN试剂观察是否变红色……(2分);
(4)浓硫酸或硫酸……(2分);品红……(2分); 29.5%……(2分)
(5)大量产生污染环境的有害气体……(2分);

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
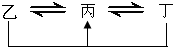 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题: