摘要:(1)n(BaSO4)=0.001mol=n(Na2SO4)故m(Na2SO4)=0.142g所以.w(Na2SO4)=0.142/0.200=71%.于是:w(Na2SO3)=1-w(Na2SO4)=29% (2)n(BaSO4)=0.001mol=n(BaCl2).所以c(BaCl2)=0.001mol/10mL=0.1mol/L
网址:http://m.1010jiajiao.com/timu3_id_339780[举报]
下列说法正确的是( )
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)?c(SO42-),所以在BaSO4溶液中有c(Ba2+)=c(SO42-)=
③将0.1mol?L-1的NaHS和0.1mol?L-1 Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1mol?L-1氨水中滴加0.1mol?L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol?L-1.
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)?c(SO42-),所以在BaSO4溶液中有c(Ba2+)=c(SO42-)=
| KSP |
③将0.1mol?L-1的NaHS和0.1mol?L-1 Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1mol?L-1氨水中滴加0.1mol?L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol?L-1.
| A、①④ | B、②③ | C、③④ | D、①② |
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M原子最外层电子数与次外层电子数之比为3:4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体.据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式)
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程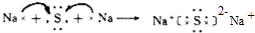
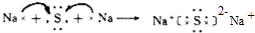 .
.
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,
写出该反应的化学方程式
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比在纯水中小.则化合物A中的化学键类型为
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是
查看习题详情和答案>>
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式)
HClO4
HClO4
.(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程
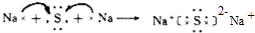
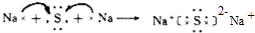
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式
H2(g)+
O2(g)═H2O(l)△H=-2akJ?mol-1
| 1 |
| 2 |
H2(g)+
O2(g)═H2O(l)△H=-2akJ?mol-1
.| 1 |
| 2 |
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,
写出该反应的化学方程式
H2O2+H2S=S↓+2H2O
H2O2+H2S=S↓+2H2O
.(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比在纯水中小.则化合物A中的化学键类型为
离子键、共价键
离子键、共价键
;若B为常见家用消毒剂的主要成分,则B的化学式是NaClO
NaClO
.(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是
HSO3-+H+=H2O+SO2↑
HSO3-+H+=H2O+SO2↑
;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
.无机化合物可根据其组成和性质进行分类:

(1)上述所示的物质分类方法名称是
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
(3)下列10种物质:①水 ②空气 ③铜丝 ④二氧化碳 ⑤硫酸 ⑥氢氧化钙
⑦盐酸 ⑧Fe(OH)3胶体 ⑨碳酸氢钙[Ca(HCO3)2]⑩NH3
属于电解质的是
(4)按要求写出下列反应的离子方程式:
①锌跟稀硫酸反应
②氢氧化钡溶液和稀硫酸反应
③MgO滴加稀盐酸
查看习题详情和答案>>

(1)上述所示的物质分类方法名称是
树状分类法
树状分类法
.(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② H2SO4或HNO3 H2SO4或HNO3 |
③ NaOH或KOH NaOH或KOH ④Ba(OH)2 |
⑤Na2CO3 ⑥ NaNO3或KNO3或K2SO4或Na2SO4 NaNO3或KNO3或K2SO4或Na2SO4 |
⑦CO2 ⑧Na2O |
⑨NH3 ⑩H2O |
⑦盐酸 ⑧Fe(OH)3胶体 ⑨碳酸氢钙[Ca(HCO3)2]⑩NH3
属于电解质的是
①、⑤、⑥、⑨
①、⑤、⑥、⑨
; 属于非电解质的是④、⑩
④、⑩
(填序号)(4)按要求写出下列反应的离子方程式:
①锌跟稀硫酸反应
Zn+2H+═Zn2++H2↑
Zn+2H+═Zn2++H2↑
②氢氧化钡溶液和稀硫酸反应
Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
③MgO滴加稀盐酸
MgO+2H+═Mg2++H2O
MgO+2H+═Mg2++H2O
. 纯净物根据其组成和性质可进行如下分类.
纯净物根据其组成和性质可进行如下分类.(1)如图所示的分类方法属于
B
B
(填序号)A.交叉分类法 B.树状分类法
(2)以H、O、S、N、K、Ba六种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | H2SO4 或HNO3 H2SO4 或HNO3 |
Ba(OH)2 或KOH Ba(OH)2 或KOH |
BaSO4、Ba(NO3)2、 KNO3、K2SO4(任写一种) BaSO4、Ba(NO3)2、 KNO3、K2SO4(任写一种) |
H2O、NO、NO2、SO2、SO3、BaO、K2O(任写一种) H2O、NO、NO2、SO2、SO3、BaO、K2O(任写一种) |
Ba(OH)2+H2SO4═BaSO4+2H2O
Ba(OH)2+H2SO4═BaSO4+2H2O
.(2008?镇江二模)世界环保组织2006年度报告指出,人类已成功地使大气中氟氯烃减少,但C、N、S氧化物的排放有增无减,水资源的紧缺和污染加剧.
(1)大气中氟氯烃的减少带来的积极效应是
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:
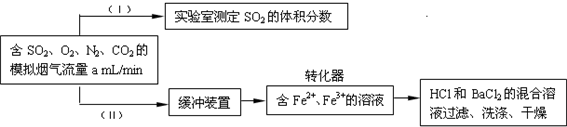
①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
查看习题详情和答案>>
(1)大气中氟氯烃的减少带来的积极效应是
减缓臭氧层空洞的增大
减缓臭氧层空洞的增大
.(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:

②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:

①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
高锰酸钾溶液(或碘水和淀粉的混合液)
高锰酸钾溶液(或碘水和淀粉的混合液)
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2 的体积分数.②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
实验时间
实验时间
和BaSO4的质量
BaSO4的质量
.