摘要:22.将0.15mol/L的NaHCO3溶液与0.2mol/L的Ba(OH)2溶液等体积混合.溶液中各离子浓度从大到小的顺序正确的是 A.c(Ba2+)>c(OH-)>c(Na+)>c(CO32-) B.c(OH-)>c(Na+)>c(Ba2+)> c(CO32-) C.c(OH-)>c(Ba2+)> c(Na+)>c(CO32-) D.c(Na+)> c(Ba2+)>c(OH-)> c(CO32-)
网址:http://m.1010jiajiao.com/timu3_id_339008[举报]
(5分)(1)将0.15mol?L-1稀硫酸V1mL与0.1 mol?L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2= 。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题。
①若由0.1mol?L-1HA溶液与0.1mol?L-1NaOH溶液等体积混合而得,则溶液的pH 7(选填“大于或等于”、 “小于或等于”、 “等于”)。
②若溶液pH>7,则c (Na+) c(A-)(选填“>”、 “<”、 “=”)。
③若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL。混合而得,则下列说法中,正确的是 (填选项符号字母)
A.若反应后溶液呈中性,则反应后溶液中[H+]+ [OH-]=2×10-7mol?L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
查看习题详情和答案>>将0.15mol MnO2和50ml 12mol?L-1浓盐酸混合后缓慢加热,充分反应可制得氯气的物质的量为( )
| A、等于0.15mol | B、大于0.15mol | C、小于0.15mol | D、以上结论都不对 |
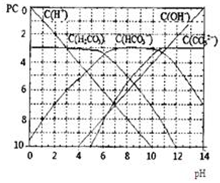 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:(1)在人体血液中,HCO3-能起到稳定人体pH的作用,请用电解质溶液中的平衡解释:
(2)H2CO3一级电离平衡常数的数值Ka1≈
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%.请你设计简单实验证明该同学的观点是否正确
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15mol?L-1.c(CO32-)=0.075mol?L-1,若t1时刻在上述体系中加入100mL0.125mol?L-1 Na2CO3溶液,列式计算说明是否有沉淀产生.