摘要:(三) 溶液计算 1.基本公式及关系: (1)物质的量浓度: ① ②稀释过程中溶质不变:C1V1=C2V2. ③同溶质的稀溶液相互混合:C混= ④质量分数换算为物质的量浓度:C= (2)溶质的质量分数. ① ②(饱和溶液.S代表溶质该条件下的溶解度) ③混合:m1a1%+m2a2%=(m1+m2)a%混 ④稀释:m1a1%=m2a2% (3)有关溶解度的计算: ①S= ②S= ③有关pH值的计算:酸算H+.碱算OH- Ⅰ. pH= -lg[H+] Ⅱ. KW=[H+][OH-]=10-14
网址:http://m.1010jiajiao.com/timu3_id_337918[举报]
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值
偏低
偏低
(填偏高、偏低或不变);(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
-56.01kJ/mol
-56.01kJ/mol
;(3)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会
偏高
偏高
(填偏高、偏低或不变),其原因是用浓硫酸代替盐酸,由于浓硫酸溶于水放热,造成测得的中和热数值偏高.
用浓硫酸代替盐酸,由于浓硫酸溶于水放热,造成测得的中和热数值偏高.
.某化学课外小组利用H2还原R2O3粉末测定R元素的相对原子质量,图是测量装置的示意图(加热装置和夹持装置略去),A中的试剂是稀盐酸,B中加入的是锌粒.
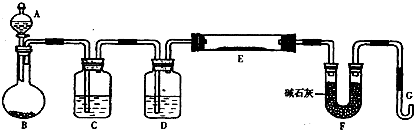
请回答下列问题:
(1)连接好装置后的实验操作依次是
①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是
(3)从G管逸出的气体需要点燃除去的原因是
(4)在稀盐酸中加入稍许CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是
(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和R2O3的总质量b;③反应后E管和R粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e;
根据以上数据可以列出三个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=
;
计算式2:Ar(R)=
;
计算式3:Ar(R)=
-24
-24.
查看习题详情和答案>>

请回答下列问题:
(1)连接好装置后的实验操作依次是
③⑤①④②
③⑤①④②
(填操作序号)①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是
水
水
,其作用为吸收氢气中的HCl气体
吸收氢气中的HCl气体
.(3)从G管逸出的气体需要点燃除去的原因是
防止逸出的氢气遇明火发生爆炸
防止逸出的氢气遇明火发生爆炸
.(4)在稀盐酸中加入稍许CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是
锌和硫酸铜反应生成铜附着在锌粒表面,在盐酸溶液中形成许多小铜锌原电池,制取氢气的速率加快
锌和硫酸铜反应生成铜附着在锌粒表面,在盐酸溶液中形成许多小铜锌原电池,制取氢气的速率加快
.(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和R2O3的总质量b;③反应后E管和R粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e;
根据以上数据可以列出三个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=
| 24(c-a) |
| b-c |
| 24(c-a) |
| b-c |
计算式2:Ar(R)=
| 27(c-a) |
| e-d |
| 27(c-a) |
| e-d |
计算式3:Ar(R)=
| 27(b-a) |
| e-d |
| 27(b-a) |
| e-d |
三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为
×100%
×100%.(不需要化简)
查看习题详情和答案>>
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容
以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL)
以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL)
,写出实验步骤④中的离子方程式:OH-+H+═H2O
OH-+H+═H2O
.(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
AC
AC
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是
减小误差,提高实验结果的准确度
减小误差,提高实验结果的准确度
.(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
C
C
(填字母选项).A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
工业上以海水为原料可获得金属镁及其多种化合物.其中Mg(OH)2是制备镁盐、耐火材料和阻燃剂等的重要原料.已知:①25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12;
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是
A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为
②计算达喜的化学式,写出必要的计算过程.
查看习题详情和答案>>
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是
B
B
.(填字母序号)A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
蓝色
蓝色
.(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为
3:1
3:1
.②计算达喜的化学式,写出必要的计算过程.
某农资商店出售一种化肥,其有效成分为氯化铵(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应),现一研究性学习小组欲测定该种化肥中氮元素的质量分数,设计了两种实验方案:
方案一 实验原理:取一定质量该化肥加入足量NaOH溶液并加热,测定产生NH3的质量.现用下列仪器组装一套实验装置:
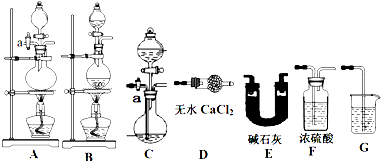
请回答下列问题:
(1)上述装置按气流的连接顺序为(用装置序号表示) .
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是 ,上述操作中若不加热导致实验的最终结果是 .
方案二 设计实验步骤如下:
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V[HCl(aq)]/mL;
⑤重复②③④步操作2次;测得的数据如下表:
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(3)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的有(填序号) .
A.玻璃棒 B.托盘天平 C.烧杯 D.药题 E.滴定管 F.容量瓶
(4)步骤④中判断滴定终点的方法是 .
(5)步骤⑤的实验目的是 .
(6)该化肥样品中氮元素的质量分数为 .(计算结果保留三位有效数字)
查看习题详情和答案>>
方案一 实验原理:取一定质量该化肥加入足量NaOH溶液并加热,测定产生NH3的质量.现用下列仪器组装一套实验装置:

请回答下列问题:
(1)上述装置按气流的连接顺序为(用装置序号表示)
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是
方案二 设计实验步骤如下:
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V[HCl(aq)]/mL;
⑤重复②③④步操作2次;测得的数据如下表:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| V[HCl(aq)]/mL | 11.95 | 12.50 | 12.05 |
请回答下列问题:
(3)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的有(填序号)
A.玻璃棒 B.托盘天平 C.烧杯 D.药题 E.滴定管 F.容量瓶
(4)步骤④中判断滴定终点的方法是
(5)步骤⑤的实验目的是
(6)该化肥样品中氮元素的质量分数为