题目内容
某农资商店出售一种化肥,其有效成分为氯化铵(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应),现一研究性学习小组欲测定该种化肥中氮元素的质量分数,设计了两种实验方案:
方案一 实验原理:取一定质量该化肥加入足量NaOH溶液并加热,测定产生NH3的质量.现用下列仪器组装一套实验装置:
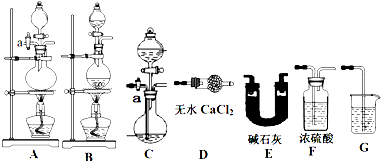
请回答下列问题:
(1)上述装置按气流的连接顺序为(用装置序号表示) .
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是 ,上述操作中若不加热导致实验的最终结果是 .
方案二 设计实验步骤如下:
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V[HCl(aq)]/mL;
⑤重复②③④步操作2次;测得的数据如下表:
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(3)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的有(填序号) .
A.玻璃棒 B.托盘天平 C.烧杯 D.药题 E.滴定管 F.容量瓶
(4)步骤④中判断滴定终点的方法是 .
(5)步骤⑤的实验目的是 .
(6)该化肥样品中氮元素的质量分数为 .(计算结果保留三位有效数字)
方案一 实验原理:取一定质量该化肥加入足量NaOH溶液并加热,测定产生NH3的质量.现用下列仪器组装一套实验装置:

请回答下列问题:
(1)上述装置按气流的连接顺序为(用装置序号表示)
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是
方案二 设计实验步骤如下:
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V[HCl(aq)]/mL;
⑤重复②③④步操作2次;测得的数据如下表:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| V[HCl(aq)]/mL | 11.95 | 12.50 | 12.05 |
请回答下列问题:
(3)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的有(填序号)
A.玻璃棒 B.托盘天平 C.烧杯 D.药题 E.滴定管 F.容量瓶
(4)步骤④中判断滴定终点的方法是
(5)步骤⑤的实验目的是
(6)该化肥样品中氮元素的质量分数为
分析:(1)根据实验原理先选择最佳的发生装置,然后根据实验目的测定产生NH3的质量完成装置连接;
(2)根据装置A、B中有残留的氨气分析;根据氨气的质量减少分析对实验的最终结果产生的影响;
(3)根据配制盐酸和氢氧化钠过程分析都能用到的仪器;
(4)根据滴定结束前溶液为红色,滴定结束时溶液为无色进行判断滴定终点;
(5)反复操作目的避免偶然性因素,减小测定误差;
(6)先判断滴定数据的有效性,然后根据有效的盐酸体积计算出消耗盐酸的平均体积,再根据氢氧化钠与氯化氢、氯化铵的反应计算出氯化铵的物质的量,最后计算出该化肥样品中氮元素的质量分数.
(2)根据装置A、B中有残留的氨气分析;根据氨气的质量减少分析对实验的最终结果产生的影响;
(3)根据配制盐酸和氢氧化钠过程分析都能用到的仪器;
(4)根据滴定结束前溶液为红色,滴定结束时溶液为无色进行判断滴定终点;
(5)反复操作目的避免偶然性因素,减小测定误差;
(6)先判断滴定数据的有效性,然后根据有效的盐酸体积计算出消耗盐酸的平均体积,再根据氢氧化钠与氯化氢、氯化铵的反应计算出氯化铵的物质的量,最后计算出该化肥样品中氮元素的质量分数.
解答:解:(1)实验原理为化肥中加入足量NaOH溶液并加热,测定产生NH3的质量,完了使测量结果更准确,反应发生装置应该选择能够加热、带有活塞的装置A,然后用碱石灰干燥后使用D氯化钙吸收,避免空气中的水分影响测量结果,装置D末端连接装有浓硫酸的装置F,所以连接顺序为:A→E→D→F,
故答案为:A→E→D→F;
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是:打开活塞a,向装置内缓缓鼓入空气,使装置中的氨气尽可能被完全吸收;由于氨气极易溶于水,上述操作中若不加热导致测量的氨气的质量减小,实验的最终使测得氮的含量偏低,
故答案为:打开活塞a,向装置内缓缓鼓入空气;使测得氮的含量偏低;
(3)配制盐酸溶液使用的仪器有:量筒、烧杯、玻璃棒、胶头滴管、容量瓶等,配制氢氧化钠溶液使用的仪器有:托盘天平、烧杯、药匙、胶头滴管、玻璃棒、容量瓶,所以配制盐酸和氢氧化钠溶液都能用到的有:烧杯、玻璃棒、容量瓶、胶头滴管,
故选ACF;
(4)滴定结束前,氢氧化钠溶液滴入酚酞,溶液为红色,滴定结束是溶液变成无色,所以滴定终点现象为:溶液由红色褪为无色且半分钟不复色,
故答案为:溶液由红色褪为无色且半分钟不复色;
(5)重复②③④步操作2次,目的是减小实验误差,使测定结果更准确,
故答案为:减小误差,提高实验结果的准确度;
(6)根据三组数据可知,第二次滴定数据误差过大,应该舍弃,其它两次滴定消耗盐酸的平均体积为:
=12.00mL,含有氯化氢的物质的量为:1.00mol/L×0.012L=0.012mol;30.00mL1.00mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1.00mol/L×0.03L=0.03mol,
所以化肥氯化铵消耗的氢氧化钠的物质的量为:0.03mol-0.012mol=0.018mol,则氯化铵的物质的量为:n(NH4Cl)=n(NaOH)=0.018mol,
该化肥样品中氮元素的质量分数为:
×100%=25.2%,
故答案为:25.2%.
故答案为:A→E→D→F;
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是:打开活塞a,向装置内缓缓鼓入空气,使装置中的氨气尽可能被完全吸收;由于氨气极易溶于水,上述操作中若不加热导致测量的氨气的质量减小,实验的最终使测得氮的含量偏低,
故答案为:打开活塞a,向装置内缓缓鼓入空气;使测得氮的含量偏低;
(3)配制盐酸溶液使用的仪器有:量筒、烧杯、玻璃棒、胶头滴管、容量瓶等,配制氢氧化钠溶液使用的仪器有:托盘天平、烧杯、药匙、胶头滴管、玻璃棒、容量瓶,所以配制盐酸和氢氧化钠溶液都能用到的有:烧杯、玻璃棒、容量瓶、胶头滴管,
故选ACF;
(4)滴定结束前,氢氧化钠溶液滴入酚酞,溶液为红色,滴定结束是溶液变成无色,所以滴定终点现象为:溶液由红色褪为无色且半分钟不复色,
故答案为:溶液由红色褪为无色且半分钟不复色;
(5)重复②③④步操作2次,目的是减小实验误差,使测定结果更准确,
故答案为:减小误差,提高实验结果的准确度;
(6)根据三组数据可知,第二次滴定数据误差过大,应该舍弃,其它两次滴定消耗盐酸的平均体积为:
| 11.95+12.05 |
| 2 |
所以化肥氯化铵消耗的氢氧化钠的物质的量为:0.03mol-0.012mol=0.018mol,则氯化铵的物质的量为:n(NH4Cl)=n(NaOH)=0.018mol,
该化肥样品中氮元素的质量分数为:
| 14g/mol×0.018mol |
| 1.00g |
故答案为:25.2%.
点评:本题考查探究物质的组成、测量物质的含量,涉及了基本实验操作以及有关计算,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

练习册系列答案
相关题目