题目内容
某化学课外小组利用H2还原R2O3粉末测定R元素的相对原子质量,图是测量装置的示意图(加热装置和夹持装置略去),A中的试剂是稀盐酸,B中加入的是锌粒.
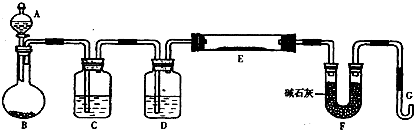
请回答下列问题:
(1)连接好装置后的实验操作依次是
①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是
(3)从G管逸出的气体需要点燃除去的原因是
(4)在稀盐酸中加入稍许CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是
(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和R2O3的总质量b;③反应后E管和R粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e;
根据以上数据可以列出三个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=
;
计算式2:Ar(R)=
;
计算式3:Ar(R)=
-24
-24.

请回答下列问题:
(1)连接好装置后的实验操作依次是
③⑤①④②
③⑤①④②
(填操作序号)①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是
水
水
,其作用为吸收氢气中的HCl气体
吸收氢气中的HCl气体
.(3)从G管逸出的气体需要点燃除去的原因是
防止逸出的氢气遇明火发生爆炸
防止逸出的氢气遇明火发生爆炸
.(4)在稀盐酸中加入稍许CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是
锌和硫酸铜反应生成铜附着在锌粒表面,在盐酸溶液中形成许多小铜锌原电池,制取氢气的速率加快
锌和硫酸铜反应生成铜附着在锌粒表面,在盐酸溶液中形成许多小铜锌原电池,制取氢气的速率加快
.(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和R2O3的总质量b;③反应后E管和R粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e;
根据以上数据可以列出三个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=
| 24(c-a) |
| b-c |
| 24(c-a) |
| b-c |
计算式2:Ar(R)=
| 27(c-a) |
| e-d |
| 27(c-a) |
| e-d |
计算式3:Ar(R)=
| 27(b-a) |
| e-d |
| 27(b-a) |
| e-d |
分析:(1)连接好装置后应首先检验装置的气密性,装置E需要加热,而氢气若与空气混合加热易爆炸,故应先从A瓶逐滴滴加液体制取氢气,用制取的氢气将装置中的空气排尽,检验H2的纯度后,点燃G管溢出的气体,然后再加热E;
(2)制取的H2中常混有杂质氯化氢和水蒸气,在H2与WO3反应前必须依次除去氯化氢,氯化氢极易溶于水,可以用水除去;
(3)根据氢气和空气混合后点燃发生爆炸来回答;
(4)依据锌和硫酸铜反应,铜析出在锌表面,在盐酸溶液中形成原电池反应,加快生成氢气的速率;
(5)根据H2与R2O3反应的化学方程式,要求R的相对原子质量,可以用固体的质量变化,也可以利用生成的H2O的质量求解.
(2)制取的H2中常混有杂质氯化氢和水蒸气,在H2与WO3反应前必须依次除去氯化氢,氯化氢极易溶于水,可以用水除去;
(3)根据氢气和空气混合后点燃发生爆炸来回答;
(4)依据锌和硫酸铜反应,铜析出在锌表面,在盐酸溶液中形成原电池反应,加快生成氢气的速率;
(5)根据H2与R2O3反应的化学方程式,要求R的相对原子质量,可以用固体的质量变化,也可以利用生成的H2O的质量求解.
解答:解:(1)连接好装置后应首先检验装置的气密性,装置E需要加热,而氢气若与空气混合加热易爆炸,故应先从A瓶逐滴滴加液体制取氢气,用制取的氢气将装置中的空气排尽,检验H2的纯度后,点燃G管溢出的气体,然后再加热E,所以顺序为③⑤①④②,故答案为:③⑤①④②;
(2)在H2与WO3反应前必须依次除去氯化氢、水蒸气,氯化氢极易溶于水,可以用水除去,故答案为:水;吸收氢气中的HCl气体;
(3)实验结束后,会有氢气剩余,保证金属氧化物全部消耗,所以最后出来的是氢气,排放到空气中遇火会发生爆炸;
故答案为:防止逸出的氢气遇明火发生爆炸;
(4)锌和硫酸铜反应,铜析出在锌表面,在盐酸溶液中形成原电池反应,加快生成氢气的速率;
故答案为:锌和硫酸铜反应生成铜附着在锌粒表面,在盐酸溶液中形成许多小铜锌原电池,制取氢气的速率加快;
(5)根据H2与R2O3反应的化学方程式,要求W的相对原子质量,可以用固体的质量变化,也可以利用生成的H2O的质量求解.
R2O3+3H2
2R+3H2O
2Ar(R)+48 2Ar(R) 54
b-a c-a e-d
因此
=
①;
=
②;
=
③;
分别求解,由①可求得Ar(R)=
;
由②可求得Ar(R)=
;
由③求的Ar(R)=
故答案为:
;
;
-24;
(2)在H2与WO3反应前必须依次除去氯化氢、水蒸气,氯化氢极易溶于水,可以用水除去,故答案为:水;吸收氢气中的HCl气体;
(3)实验结束后,会有氢气剩余,保证金属氧化物全部消耗,所以最后出来的是氢气,排放到空气中遇火会发生爆炸;
故答案为:防止逸出的氢气遇明火发生爆炸;
(4)锌和硫酸铜反应,铜析出在锌表面,在盐酸溶液中形成原电池反应,加快生成氢气的速率;
故答案为:锌和硫酸铜反应生成铜附着在锌粒表面,在盐酸溶液中形成许多小铜锌原电池,制取氢气的速率加快;
(5)根据H2与R2O3反应的化学方程式,要求W的相对原子质量,可以用固体的质量变化,也可以利用生成的H2O的质量求解.
R2O3+3H2
| ||
2Ar(R)+48 2Ar(R) 54
b-a c-a e-d
因此
| 2Ar(R)+48 |
| b-a |
| 2Ar(R) |
| c-a |
| 2Ar(R) |
| c-a |
| 54 |
| e-d |
| 2Ar(R)+48 |
| b-a |
| 54 |
| e-d |
分别求解,由①可求得Ar(R)=
| 24(c-a) |
| b-c |
由②可求得Ar(R)=
| 27(c-a) |
| e-d |
由③求的Ar(R)=
故答案为:
| 24(c-a) |
| b-c |
| 27(c-a) |
| e-d |
| 27(b-a) |
| e-d |
点评:本题主要考查了R元素的相对原子质量的测定,同时还考查了基本实验操作,综合性较强,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
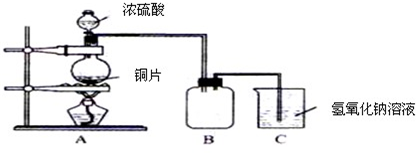
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
在上述条件下反应能够自发进行,则反应的△H 0(“>”、“<”、“=”).前2h内的平均反应速率v(N2)= ,在该温度下,反应的平衡常数K= .据此你认为将该反应从理论转化为现实的最重要的研究方向是 .

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.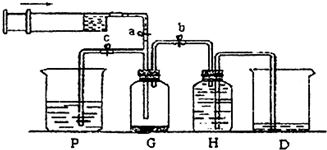
 英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。 (2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。 (3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
(3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题: