摘要:1.解题步骤 (1)看懂图像:看图像要五看.一看面.即看清横坐标和纵坐标的意义,二看线.即看线的走向和变化趋势,三看点.即看曲线的起点.终点.交点.拐点.原点.极值点等,四看辅助线.即要不要作辅助线.如等温线.等压线,五看量的变化.即定量图像中有关量的多少.如浓度变化.温度变化等. (2)联想规律:即联想外界条件的改变对化学反应速率和化学平衡的影响规律. (3)推理判断:根据给定的化学反应和图像中呈现的关系与所学规律相对比.作出符合题目要求的判断.
网址:http://m.1010jiajiao.com/timu3_id_336322[举报]
纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定.CaO2?8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2.在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2.其制备过程如下:
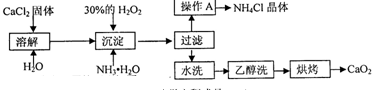
根据以上信息,同答下列问题:
(1)用上述方法制取CaO2?8H2O的化学方程式是 ;
(2)操作A的步骤为 ;
(3)检验“水洗”已经洗净的方法是 ;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2mol?L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL.
①第三步反应完全时的现象为 ;
②产品中CaO2的质量分数为 (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) .
查看习题详情和答案>>

根据以上信息,同答下列问题:
(1)用上述方法制取CaO2?8H2O的化学方程式是
(2)操作A的步骤为
(3)检验“水洗”已经洗净的方法是
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2mol?L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL.
①第三步反应完全时的现象为
②产品中CaO2的质量分数为
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示)
(2011?四川模拟)迷迭香酸存在于紫苏、蜜蜂花等植物中,具有抗菌防霉活性,常用于化妆品中.它的结构简式(用A表示)为:
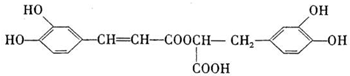
A可由有机物B和C反应得到,且B的相对分子质量比C大18.
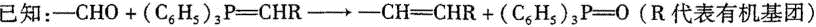
B的合成步骤如下(D、E、F、G分别代表一种物质):

第二步:E与F在催化剂作用下反应生成C和C2H5OH
第三步:C与F在催化剂作用下反应生成B和G
请回答下列问题:
(1)1molA与足量的氢氧化钠溶液反应,最多消耗氢氧化钠的物质的量为
(2)B的结构简式是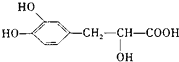
 .
.
(3)与C的官能团相同,且两个羟基处于苯环对位的C的同分异构体有
(4)在B的合成中,第一步反应的化学方程式是
 .
.
(5)G的结构简式是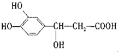
 .
.
查看习题详情和答案>>

A可由有机物B和C反应得到,且B的相对分子质量比C大18.
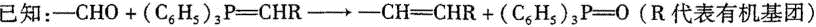
B的合成步骤如下(D、E、F、G分别代表一种物质):

第二步:E与F在催化剂作用下反应生成C和C2H5OH
第三步:C与F在催化剂作用下反应生成B和G
请回答下列问题:
(1)1molA与足量的氢氧化钠溶液反应,最多消耗氢氧化钠的物质的量为
6
6
mol.(2)B的结构简式是


(3)与C的官能团相同,且两个羟基处于苯环对位的C的同分异构体有
5
5
种.(4)在B的合成中,第一步反应的化学方程式是


(5)G的结构简式是


Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a .
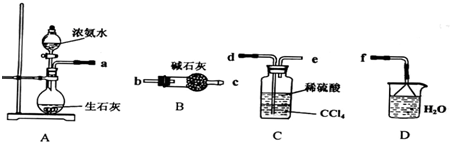
(2)将装置C中两种液体分离开的操作名称是 .装置D的作用是 .
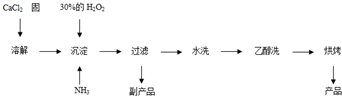
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:
已知CaO2?8H2O呈白色,微溶于水.I2+2S2O32-=2I-+S4O62-
(1)用上述方法制取CaO2?8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
①判断此滴定实验达到终点的方法是: .
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”).
查看习题详情和答案>>

(2)将装置C中两种液体分离开的操作名称是
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:

已知CaO2?8H2O呈白色,微溶于水.I2+2S2O32-=2I-+S4O62-
(1)用上述方法制取CaO2?8H2O的化学方程式是
(2)检验“水洗”是否合格的方法是
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
①判断此滴定实验达到终点的方法是:
②CaO2的质量分数为
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol?L-1的HCl溶液和0.1mol?L-1的NaOH溶液各250mL.
b.取0.5g磨碎后的胃药于锥形瓶中.
c.向锥形瓶内加入25.00mL 0.1mol?L-1的HCl溶液.
d.以酚酞为指示剂,用0.1mol?L-1的NaOH溶液滴定,至达到滴定终点.
e.重复bcd三步的操作2次.
(1)操作c中量取盐酸体积的仪器是
(2)若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将
(3)滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
(4)碱式滴定管读数时,用仰视记终点
(5)若滴定中NaOH溶液的平均用量为5.00mL,则胃药中碳酸钙的质量分数为
查看习题详情和答案>>
a.配制0.1mol?L-1的HCl溶液和0.1mol?L-1的NaOH溶液各250mL.
b.取0.5g磨碎后的胃药于锥形瓶中.
c.向锥形瓶内加入25.00mL 0.1mol?L-1的HCl溶液.
d.以酚酞为指示剂,用0.1mol?L-1的NaOH溶液滴定,至达到滴定终点.
e.重复bcd三步的操作2次.
(1)操作c中量取盐酸体积的仪器是
酸式滴定管
酸式滴定管
.(2)若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将
偏小
偏小
(选填“偏大”、“偏小”或“无影响”).(3)滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
偏大
偏大
.(4)碱式滴定管读数时,用仰视记终点
偏小
偏小
.(5)若滴定中NaOH溶液的平均用量为5.00mL,则胃药中碳酸钙的质量分数为
50%
50%
.某中学化学兴趣小组在课外活动时,对学校附近的甲、乙两条河流的 水质进行了多次检测. 第一组检测甲河流的水质结果如下:
(1)三次检测结果中第
(2)在检测时,为了确定溶液中是否存在S
、CO32-和Cl-,该小组进行了如下实验,请你参与探究与分析.
(3)第二组对乙河流进行检测,乙河流两边有甲、乙两工厂,经检测它们排放的工业废水中共含有K+、Ag+、Fe3+、Cl-、OH-、N
六种离子.并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为
查看习题详情和答案>>
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
二
二
次的结果肯定不正确.(2)在检测时,为了确定溶液中是否存在S
| O | 2- 4 |
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 | ||
| 第一步 | 向溶液中滴加过量的HNO3溶液 | 检验 CO32- CO32- 的存在 |
2H++CO32-═CO2↑+H2O 2H++CO32-═CO2↑+H2O | ||
| 第二步 | 继续滴加过量的 Ba(NO3)2 Ba(NO3)2 溶液 |
检验S
|
|||
| 第三步 | 过滤,再向溶液中滴加 AgNO3 AgNO3 溶液 |
检验 Cl- Cl- 的存在 |
Ag++Cl-═AgCl↓ |
| O | - 3 |
OH-
OH-
、K+
K+
、Cl-
Cl-
.