摘要:13.(1)B为FeSO4 C为H2S (2)SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
网址:http://m.1010jiajiao.com/timu3_id_336095[举报]
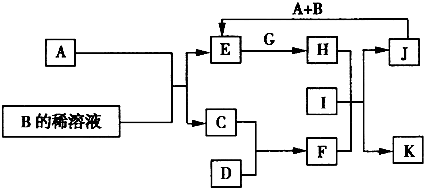
A~L为中学化学常见的物质,其主要转化关系如图所示(其中产物水已略去).已知A为常见的金属单质,C、D通常状况下为气体单质,B、F均为重要的化工产品,B的浓溶液具有较强的腐蚀性,F为具有刺激性气味的气体.将一定量的F通入B的稀溶液中可以生成两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
试回答下列问题:
(1)B的化学式为
(2)向E的溶液中加入氢氧化钠溶液的实验现象为
(3)写出E的酸性溶液与G反应生成H的离子方程式:
(4)检验H溶液中的阳离子应选用试剂为,实验现象为
(5)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为pH(K溶液)
查看习题详情和答案>>

试回答下列问题:
(1)B的化学式为
H2SO4
H2SO4
;工业上冶炼金属A的方法称为热还原法
热还原法
.(2)向E的溶液中加入氢氧化钠溶液的实验现象为
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
,发生反应的化学方程式为FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(3)写出E的酸性溶液与G反应生成H的离子方程式:
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)检验H溶液中的阳离子应选用试剂为,实验现象为
溶液由黄色变为血红色
溶液由黄色变为血红色
.(5)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为pH(K溶液)
>
>
pH(L溶液)(填“>”、“<”或“=”),其主要原因是NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
(用离子方程式解释).(2010?南通模拟)某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4?7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为
(2)“碱浸”过程中发生的离子方程式是
(3)“酸浸”时所加入的酸是
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是
(5)“调pH为2~3”的目的是
(6)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),其原因可能是
查看习题详情和答案>>

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为
漏斗、蒸发皿
漏斗、蒸发皿
.(2)“碱浸”过程中发生的离子方程式是
2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
.(3)“酸浸”时所加入的酸是
H2SO4
H2SO4
(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+
Ni2+、Fe2+
.(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是
3.2-9.2
3.2-9.2
.(5)“调pH为2~3”的目的是
防止在浓缩结晶过程中Ni2+水解
防止在浓缩结晶过程中Ni2+水解
.(6)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),其原因可能是
H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的
H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的
.聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和
查看习题详情和答案>>

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
ab
ab
.(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是
C
C
和确定氧化Fe2+所需NaClO3的量:(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
6
6
Fe2++1
1
ClO3-+6
6
H+=6
6
Fe3++Cl-+3H2O
3H2O
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂
ac
ac
.(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和
BaSO4
BaSO4
的质量(填写化合物的化学式).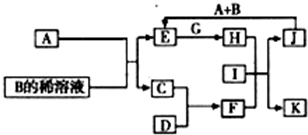 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.(1)工业上冶炼金属A的方法称为
热还原法
热还原法
.(2)向E的溶液中加入氢氧化钠溶液的实验现象为
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
,反应的化学方程式为FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(3)写出E的酸性溶液与G反应转化为H的离子方程式
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K
>
>
L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明)NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
.(2010?江苏二模)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,现用铁的氧化物为原料来制取聚合硫酸铁的过程如下:
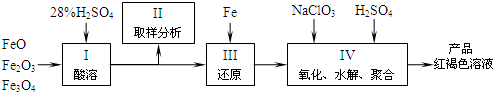
(1)用98%的硫酸配制28%的稀硫酸,所需的玻璃仪器除量筒外,还有
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶
(2)配平以下离子方程式:
(3)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.为了测定聚合硫酸铁中SO42-与Fe3+物质的量之比,应选择的试剂是
A.NaOH B.FeSO4 C.BaCl2 D.NaClO3
实验时需要测定的量是Fe2O3和
查看习题详情和答案>>

(1)用98%的硫酸配制28%的稀硫酸,所需的玻璃仪器除量筒外,还有
AB
AB
.A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶
(2)配平以下离子方程式:
6
6
Fe2++1
1
ClO3-+6
6
H+=6
6
Fe3++1
1
Cl-+3H2O
3H2O
(3)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.为了测定聚合硫酸铁中SO42-与Fe3+物质的量之比,应选择的试剂是
AC
AC
(填序号).A.NaOH B.FeSO4 C.BaCl2 D.NaClO3
实验时需要测定的量是Fe2O3和
BaSO4
BaSO4
的质量(填写化合物的化学式).