摘要:下列说法正确的是( ) A.53.5gNH4Cl中含有H-Cl键的个数为4NA B.12g石墨中含有C-C键的个数为4NA C.12g金刚石中含有C-C键的个数为4NA D.60gSiO2中含有Si-O键的个数为4NA
网址:http://m.1010jiajiao.com/timu3_id_335249[举报]
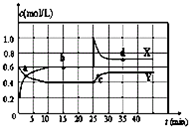 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,NO2和N2O4浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,NO2和N2O4浓度随时间变化关系如图.下列说法不正确的是( )
查看习题详情和答案>>
(2010?扬州模拟)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为
查看习题详情和答案>>
(1)基态钛原子的核外电子排布式为
[Ar]3d24s2
[Ar]3d24s2
.(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
分子
分子
晶体.(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是
B
B
.A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是
MgO
MgO
,原因是均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高
均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高
.(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为
sp3
sp3
,分子的空间构型为V形(折线形)
V形(折线形)
.(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为
2:3
2:3
.
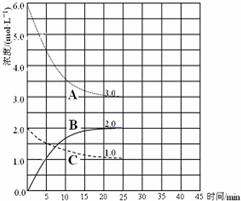 合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象
合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象下列说法正确的是( )
| A、前25min内,用H2浓度变化表示的化学反应平均速率是0.04 mol?L-1?min-1 | B、在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=0.148 | C、该反应达到平衡时放出热量为92kJ | D、V正(N2)=2V逆(NH3)说明到达平衡状态 |
