题目内容
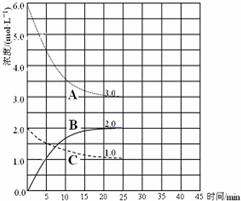 合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象
合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象下列说法正确的是( )
| A、前25min内,用H2浓度变化表示的化学反应平均速率是0.04 mol?L-1?min-1 | B、在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=0.148 | C、该反应达到平衡时放出热量为92kJ | D、V正(N2)=2V逆(NH3)说明到达平衡状态 |
分析:A.由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,根据v=
计算v(H2);
B.由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,代入平衡常数表达式计算;
C.容器的体积未知,无法计算参加反应的反应物的物质的量;
D.不同物质表示的正、逆速率之比等于化学计量数之比,说明反应到达平衡状态.
| △c |
| △t |
B.由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,代入平衡常数表达式计算;
C.容器的体积未知,无法计算参加反应的反应物的物质的量;
D.不同物质表示的正、逆速率之比等于化学计量数之比,说明反应到达平衡状态.
解答:解:A.由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,故v(H2)=
=0.12 mol?L-1?min-1,故A错误;
B.由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,故平衡常数k=
=0.148,故B正确;
C.容器的体积未知,无法计算参加反应的反应物的物质的量,无法计算反应热,故C错误;
D.V正(N2)=2V逆(NH3),即V正(N2):V逆(NH3)=2:1,不等于1:2,反应未到达平衡状态,向正反应进行,故D错误;
故选B.
| 3mol/L |
| 25min |
B.由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,故平衡常数k=
| 22 |
| 1×33 |
C.容器的体积未知,无法计算参加反应的反应物的物质的量,无法计算反应热,故C错误;
D.V正(N2)=2V逆(NH3),即V正(N2):V逆(NH3)=2:1,不等于1:2,反应未到达平衡状态,向正反应进行,故D错误;
故选B.
点评:本题考查化学平衡图象、反应速率计算、化学平衡常数、反应热计算、化学平衡状态判断等,难度中等,判断图象A、B、C代表的物质是关键.

练习册系列答案
相关题目
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义. Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
 2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
 2NH3(g) △H ="
-92" kJ·mol-1
2NH3(g) △H ="
-92" kJ·mol-1