网址:http://m.1010jiajiao.com/timu3_id_335102[举报]
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
①请根据上述信息,写出A基态原子的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。

(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
(12分,每空3分)请根据下面的反应路线及所给的信息,用中学化学知识回答问题:
已知A是一种直链一溴代物,1molA与1molH2反应生成1molG,F是环状化合物,环上有5个原子,其化学式为C4H6O2。
(1)化合物F的结构简式是______________,化合物C的结构简式是_____________。
(2)化合物A含有的官能团是____________ ______________。
(3)1molA与2molG的化学方程式是___________ ______________。
查看习题详情和答案>>
(12分,每空3分).
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol-1;
查看习题详情和答案>>
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表: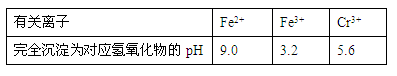
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
(14分,每空2分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应
6NO2+ 8NH3 7N2+12
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2 (g)
(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
①写出NO2氧化SO2的热化学方程式
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明 反应达到平衡状态的是 。
反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。