题目内容
(14分,每空2分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应
6NO2+ 8NH3 7N2+12
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2 (g)
(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
①写出NO2氧化SO2的热化学方程式
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明 反应达到平衡状态的是 。
反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
(每空2分,共14分)
(1)3NO2+H2O=NO+2HNO3;6.72
(2)①NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJ?mol-1;②b;③8/3;
(3)<;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失
解析

 特高级教师点拨系列答案
特高级教师点拨系列答案(14分,每空2分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下: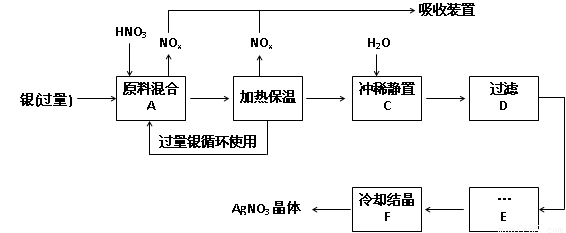
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
|
|
(2)步骤B加热保温的作用是 :
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 ;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:
;
(5)步骤E进行的操作是 。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为: 。
 CO + H2O,
CO + H2O, L。该条件下的平衡常数为K3。则K3________K1
L。该条件下的平衡常数为K3。则K3________K1 )=1.2mol,n(H2)=1.5mol,
)=1.2mol,n(H2)=1.5mol, 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。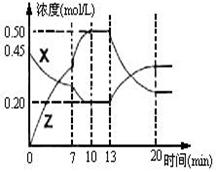
 CO + H2O,
CO + H2O, 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。