摘要: 已知KMnO4溶液与KNO2溶液反应的离子方程式如下:MNO4-+NO2-+□→Mn2+ + NO3- +H2O.下列说法正确的是 A.MnO4-发生了氧化反应 B.氧化剂与还原剂的物质的量之比是3:1 C.氧化产物与还原产物物质的量之比是5:2 D.方程式空格中的物质应是OH-
网址:http://m.1010jiajiao.com/timu3_id_332328[举报]
为了测定血液中钙离子的含量,取5毫升血液样品,稀释成50毫升,从中取出10毫升,加入过量草酸钾(K2C2O4)溶液,使钙离子完全转化成草酸钙沉淀。滤出并洗净所得草酸钙沉淀,用过量稀硫酸溶解,生成草酸和硫酸钙稀溶液。往溶液中加入10毫升0.0020mol/L的KMnO4溶液,使草酸完全被氧化,再用FeSO4溶液滴定过量的KMnO4溶液,当KMnO4溶液的紫红色刚好褪去时,耗0.10mol/L的FeSO4溶液8.9毫升。已知KMnO4溶液和草酸、FeSO4溶液的反应可表示为(未配平):
MnO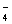 +H2C2O4+H+®CO2+Mn2++H2O
+H2C2O4+H+®CO2+Mn2++H2O
MnO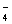 +Fe2++H+®Fe3++Mn2++H2O
+Fe2++H+®Fe3++Mn2++H2O
求血样中钙离子的含量(以100毫升血液中含钙离子多少克表示)。 查看习题详情和答案>>
MnO
MnO
求血样中钙离子的含量(以100毫升血液中含钙离子多少克表示)。 查看习题详情和答案>>
 硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+
硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+| 1 | 2 |
(1)反应达到平衡时SO2(g)的平衡转化率为
(2)已知Mn2+溶液显无色.若将足量SO2通入酸化的KMnO4溶液中,充分振荡后溶液颜色褪去,由此说明SO2具有
(3)天然海水中主要含有Na+、K+、Ca2+、Cl-、HCO3-等离子,其pH约为8,原因是
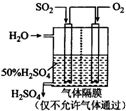
(4)若以如图所示装置,用电化学原理生产硫酸,该装置中通入SO2的一极的电极反应式为
若有96g SO2(g)被完全氧化,利用所产生的电能电解足量的CuSO4溶液(假设能量总利用率为80%),则理论上将产生标准状况下O2的体积是
(2012?浦东新区二模)酒后驾车已成为一个社会问题.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O.
上述反应中发生还原反应的过程是
(2)已知KMnO4在酸性条件下氧化性增强,能得到更多的电子,若在稀硫酸中反应的氧化产物为乙酸,则还原产物为
(3)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为
(4)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段.其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是
查看习题详情和答案>>
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O.
上述反应中发生还原反应的过程是
KMnO4
KMnO4
→MnO2
MnO2
.(2)已知KMnO4在酸性条件下氧化性增强,能得到更多的电子,若在稀硫酸中反应的氧化产物为乙酸,则还原产物为
MnSO4
MnSO4
;若反应产生了12.0mg乙酸,则转移的电子数目是0.0008NA
0.0008NA
.(3)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为
I2O5+5CH3CH2OH→I2+5CH3CHO+5H2O
I2O5+5CH3CH2OH→I2+5CH3CHO+5H2O
.(4)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段.其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是
O2
O2
(填写化学式).(2012?徐汇区二模)已知KMnO4 可以与浓盐酸反应制取氯气.紫色KMnO4溶液在不同条件下的还原过程如下:①MnO4-+e-→MnO42-(绿色) (强碱性条件)
②MnO4-+8H++5e-→Mn2+(无色)+4H2O(强酸性条件)
(1)将KMnO4溶液滴入 KOH与 K2SO3的混合溶液发生化学反应,还原剂为
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,反应的离子方程式为
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,最合适的亚铁盐是
a.FeSO4 b.FeCl2 c.Fe(NO3)2 d.盐酸 e.稀硝酸 f.稀硫酸
(4)向20mL浓度为0.02mol/L的KMnO4溶液中滴加FeSO4溶液,使紫色MnO4-全部转化为无色,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于
查看习题详情和答案>>
②MnO4-+8H++5e-→Mn2+(无色)+4H2O(强酸性条件)
(1)将KMnO4溶液滴入 KOH与 K2SO3的混合溶液发生化学反应,还原剂为
K2SO3
K2SO3
,还原产物为K2MnO4
K2MnO4
.(填写化学式)(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,反应的离子方程式为
4MnO4-+4OH-=4MnO42-+2H2O+O2↑
4MnO4-+4OH-=4MnO42-+2H2O+O2↑
.(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,最合适的亚铁盐是
a
a
,可用来酸化KMnO4溶液的试剂是f
f
(均选填字母编号).a.FeSO4 b.FeCl2 c.Fe(NO3)2 d.盐酸 e.稀硝酸 f.稀硫酸
(4)向20mL浓度为0.02mol/L的KMnO4溶液中滴加FeSO4溶液,使紫色MnO4-全部转化为无色,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于
3.2
3.2
mL. 已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol?L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应.试回答下列问题:
(1)0.0200mol?L-1KMnO4标准溶液应置于
甲
甲
(选填“甲”或“乙”)滴定管中;滴定终点如何判断当看到滴入一滴KMnO4溶液,锥形瓶中溶液立即变成紫色,且半分钟不褪色,即达到滴定终点
当看到滴入一滴KMnO4溶液,锥形瓶中溶液立即变成紫色,且半分钟不褪色,即达到滴定终点
.(2)你能否帮助该研究小组求得软锰矿中MnO2的质量分数
否
否
(选填“能”或“否”).若回答“能”,请给出计算结果否
否
;若回答“否”,试说明原因不知道容量瓶的规格
不知道容量瓶的规格
.(3)若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是
BC
BC
.A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之后未用待测液润洗.