��Ŀ����
 ���ᱻ��Ϊ����ҵ֮ĸ����������ڹ�ҵ�����е���Ҫ��λ�����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ��������Ĺؼ����裮һ���¶��£���һ�������������Ϊ2L���ܱ������г���2.0mol SO2��g����1.0mol O2��g����������Ӧ��SO2��g��+
���ᱻ��Ϊ����ҵ֮ĸ����������ڹ�ҵ�����е���Ҫ��λ�����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ��������Ĺؼ����裮һ���¶��£���һ�������������Ϊ2L���ܱ������г���2.0mol SO2��g����1.0mol O2��g����������Ӧ��SO2��g��+| 1 | 2 |
��1����Ӧ�ﵽƽ��ʱSO2��g����ƽ��ת����Ϊ
��2����֪Mn2+��Һ����ɫ����������SO2ͨ���ữ��KMnO4��Һ�У��������Һ��ɫ��ȥ���ɴ�˵��SO2����
��3����Ȼ��ˮ����Ҫ����Na+��K+��Ca2+��Cl-��HCO3-�����ӣ���pHԼΪ8��ԭ����
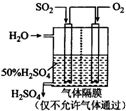
��4��������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬ��װ����ͨ��SO2��һ���ĵ缫��ӦʽΪ
����96g SO2��g������ȫ�����������������ĵ��ܵ��������CuSO4��Һ������������������Ϊ80%�����������Ͻ�������״����O2�������
��������1���������ݻ��ɱ䣬�÷�ӦΪ���º�ѹ���������ݻ�������������ʵ��������ȣ������������ݻ��仯�Ͳ������������Ӧ���ĵĶ����������������ɵ�������������ʵ������ٸ���ת���ʡ�ƽ�ⳣ���ı���ʽ���м��㣻
��2�����Ը�����ؾ���ǿ�����ԣ�����������л�ԭ�ԣ����߷�����������ԭ��Ӧ������������������������ӣ���������е���Ԫ�ر���ԭ�������ӣ��ݴ�д����Ӧ�����ӷ���ʽ��
��3��̼����������ܹ����ˮ����������ӣ�ʹ��Һ��ʾ�����ԣ��ݴ�д����Ӧ�����ӷ���ʽ��
��4��ԭ��ظ�������������Ӧ��SO2����������SO42-�����������������õ缫Ϊ���������ݵ���������������Ӵ�����ɽ����ж�SO42-���ƶ������ݵ����غ��������ɵı���������������
��2�����Ը�����ؾ���ǿ�����ԣ�����������л�ԭ�ԣ����߷�����������ԭ��Ӧ������������������������ӣ���������е���Ԫ�ر���ԭ�������ӣ��ݴ�д����Ӧ�����ӷ���ʽ��
��3��̼����������ܹ����ˮ����������ӣ�ʹ��Һ��ʾ�����ԣ��ݴ�д����Ӧ�����ӷ���ʽ��
��4��ԭ��ظ�������������Ӧ��SO2����������SO42-�����������������õ缫Ϊ���������ݵ���������������Ӵ�����ɽ����ж�SO42-���ƶ������ݵ����غ��������ɵı���������������
����⣺��1�����º�ѹ�����£���������֮�Ⱦ͵������ʵ���֮�ȣ���Ӧ��Ӧ������������ʵ���Ϊ����2mol+1mol��
=2.4mol���ﵽƽ��ʱ��������С��0.6mol���跴Ӧ�����˶�������xmol������ymol��������zmol��������
SO2��g��+
O2?SO3��g����n
1 0.5 1 0.5
x y z 0.6mol
�������Ϲ�ϵ�ɵã�x=1.2mol��y=0.6mol��z=1.2mol��
SO2��g����ƽ��ת����Ϊ��
��100%=60%��
��ƽ��ʱ��c��SO2��=
=0.4mol/L��c��O2��=
=0.2mol/L��c��SO3��=
=0.6mol/L��
����k=
=
=
��3.35��
�ʴ�Ϊ��60%��3��
��2�����������Һ��ɫ��˵��������ر���ԭ������������л�ԭ�ԣ���Ӧ�����ӷ���ʽΪ��5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+��
�ʴ�Ϊ����ԭ�ԣ�5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+��
��3��̼�����������Һ�з�����ˮ�⣬��Ӧ�����ӷ���ʽΪ��HCO3-+H2O?H2CO3+OH-��������Һ������������Ũ�ȴ���������Ũ�ȣ���Һ��ʾ���ԣ�
�ʴ�Ϊ��HCO3-+H2O?H2CO3+OH-��
��4��ԭ��ظ�������������Ӧ��SO2����������SO42-�������缫��ӦʽΪ��SO2+2H2O-2e-=SO42-+4H+��������������������Ӧ�����Զ�������ĵ缫Ϊ�����������ĵ缫Ϊ��������������Ϊ�����������������·������������Һ���������ң�������Һ��SO42-���ƶ���������������෴�����ҵ���
96g SO2��g�������ʵ���Ϊ1.5mol��ʧȥ���ӵ����ʵ���Ϊ3mol��������������Ϊ80%�����ת�Ƶĵ��ӵ����ʵ���Ϊ��3mol��80%=2.4mol��
1mol������Ӧ�õ�4mol���ӣ���ת��2.4mol���ӣ��������������ʵ���Ϊ��
=0.6mol��
��������������������22.4L/mol��0.6mol=13.44 L��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+�����ҵ���13.44��
| 1.6L |
| 2L |
SO2��g��+
| 1 |
| 2 |
1 0.5 1 0.5
x y z 0.6mol
�������Ϲ�ϵ�ɵã�x=1.2mol��y=0.6mol��z=1.2mol��
SO2��g����ƽ��ת����Ϊ��
| 1.2 |
| 2 |
��ƽ��ʱ��c��SO2��=
| 2.0mol-1.2mol |
| 2L |
| 1.0mol-0.6mol |
| 2L |
| 1.2mol |
| 2L |
����k=
| c(SO3) | ||
c(SO2)?c
|
| 0.6 | ||
0.4��(0.2)
|
| 0.6 |
| 0.4��0.4472 |
�ʴ�Ϊ��60%��3��
��2�����������Һ��ɫ��˵��������ر���ԭ������������л�ԭ�ԣ���Ӧ�����ӷ���ʽΪ��5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+��
�ʴ�Ϊ����ԭ�ԣ�5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+��
��3��̼�����������Һ�з�����ˮ�⣬��Ӧ�����ӷ���ʽΪ��HCO3-+H2O?H2CO3+OH-��������Һ������������Ũ�ȴ���������Ũ�ȣ���Һ��ʾ���ԣ�
�ʴ�Ϊ��HCO3-+H2O?H2CO3+OH-��
��4��ԭ��ظ�������������Ӧ��SO2����������SO42-�������缫��ӦʽΪ��SO2+2H2O-2e-=SO42-+4H+��������������������Ӧ�����Զ�������ĵ缫Ϊ�����������ĵ缫Ϊ��������������Ϊ�����������������·������������Һ���������ң�������Һ��SO42-���ƶ���������������෴�����ҵ���
96g SO2��g�������ʵ���Ϊ1.5mol��ʧȥ���ӵ����ʵ���Ϊ3mol��������������Ϊ80%�����ת�Ƶĵ��ӵ����ʵ���Ϊ��3mol��80%=2.4mol��
1mol������Ӧ�õ�4mol���ӣ���ת��2.4mol���ӣ��������������ʵ���Ϊ��
| 2.4mol |
| 4 |
��������������������22.4L/mol��0.6mol=13.44 L��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+�����ҵ���13.44��
���������⿼���˻�ѧƽ�ⳣ�������ӷ���ʽ����д��ԭ��غ͵��ع���ԭ������Ŀ�Ѷ��еȣ�ע�����ջ�ѧƽ�ⳣ���ĸ������ʽ��ԭ��غ͵��ع���ԭ���������ܹ�����ѧ���ķ���������������

��ϰ��ϵ�д�
�����Ŀ