摘要:14.臭氧层是地球生命的保护神.臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O22O3. (1)若在上述反应中有30%的氧气转化为臭氧.所得混合气的平均摩尔质量为 g/mol. (2)将8 L氧气通过放电管后.恢复到原状况.得到气体6.5 L.其中臭氧为 L. (3)实验室将氧气和臭氧的混合气体0.896 L通入盛有20.0 g铜粉的反应器中.充分加热后.粉末的质量变为21.6 g.则原混合气中臭氧的体积分数为 . 解析:(1)假设有1 mol O2.则 3O2 ―→ 2O3 开始 1 mol 0 反应 0.3 mol 0.2 mol 平衡 0.7 mol 0.2 mol 所以混合气的平均摩尔质量为:×32 g·mol-1+×48 g·mol-1=35.6 g·mol-1. (2)此题应根据差量法计算 3O2 ―→ 2O3 ΔV 3 2 1
网址:http://m.1010jiajiao.com/timu3_id_33129[举报]
(2009?上海)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O2
2O3
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为
查看习题详情和答案>>
| 通电 |
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
35.6
35.6
g/mol (保留一位小数).(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
3
3
L.(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为
0.5
0.5
.
(1)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O 2
2O3若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为 (保留一位小数).
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则1mol O3与 L(标准状况下)Cl2的消毒能力相当.
查看习题详情和答案>>
| 放电 |
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则1mol O3与
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O22O3.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
查看习题详情和答案>>
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
35.6
35.6
g/mol(保留一位小数).(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
3
3
L.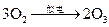
 器中,充分加热后,粉末的质量变为21.6g。原混合气中臭氧的体积分数为__________________。
器中,充分加热后,粉末的质量变为21.6g。原混合气中臭氧的体积分数为__________________。