网址:http://m.1010jiajiao.com/timu3_id_328047[举报]
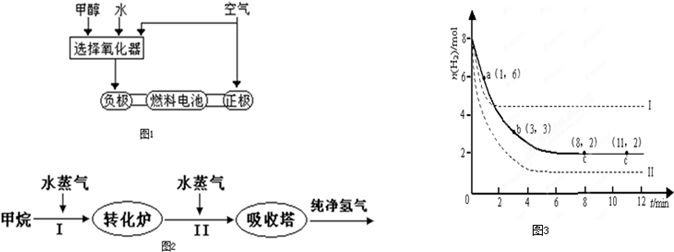
①此碱性燃料电池的正极反应式为
②甲醇与水反应制取氢气的化学方程式
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图2:
①此流程的第II步反应为:CO(g)+H2O(g)
| 高温 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
②若400℃时,第Ⅱ步反应生成l mol氢气放出的热量为33.2kJ,第I步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1 则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
(3)工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)
将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线).
①a点正反应速率
②求平衡时氢气的转化率
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图3虚线所示,曲线I对应的实验条件改变是
(1)工业接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1该热化学反应方程式的意义是
(2)在25℃、101kPa下,1g甲醇[CH3OH(l)]燃烧生成CO2和液态水时放热.22.68kJ.则表示甲醇燃烧热的热化学方程式为
| 3 |
| 2 |
| 3 |
| 2 |
(3)已知25℃、l01kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
| 1 |
| 2 |
(4)由N2和H2合成1molNH3时可放出46.2kJ的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
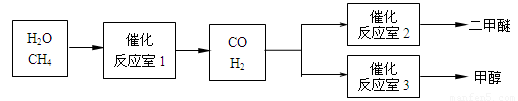
(14分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H>0。
CO(g)+3H2(g)△H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)= mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
① P1 P2 (填“<”、“>”或“=”)。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”,下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g) CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
查看习题详情和答案>>
(14分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
 请填空:
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0。
CO(g)+3H2(g)
△H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)= mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
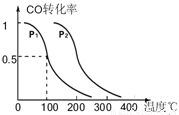
① P1 P2 (填“<”、“>”或“=”)。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”,下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
查看习题详情和答案>>
(14分)甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。①CH4(g)+H2O (g)  CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
 CH3OH(g) △H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
CH3OH(g) △H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
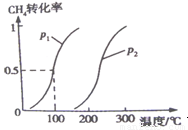
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”.“减小”.“不变”),平衡向 方向移动。
(2)反应①的△H1 0,(填“﹤”“﹦”“﹥”),其平衡常数表达式为K= ,100℃,压强为p1时平衡常数的值是 。
(3)在压强为0.1Mpa条件下,将a mol CO与3a molH2的混合气体在催化剂作用下进行反应②。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下空格中填入剩余的实验条件数据。
|
实验编号 |
T℃ |
n(CO)/n(H2) |
p (Mpa) |
|
I |
150 |
1/3 |
0.1 |
|
Ⅱ |
|
|
5 |
|
Ⅲ |
350 |
|
5 |
(4)近几年开发的甲醇燃料电池是采用铂电极,电池中的质子交换膜只允许质子和水分子通过,其工作原理示意图如下:
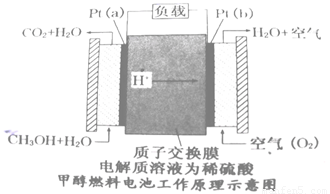
请回答
①Pt(a)电极的电极反应式为
②如果该电池工作时电路中通过2mol电子则消耗的CH3OH有 mol。
查看习题详情和答案>>