网址:http://m.1010jiajiao.com/timu3_id_323614[举报]
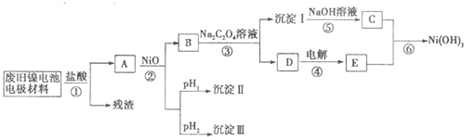
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Kap及沉淀析出的理论pH如下表所示:
| M(OH)n | Kap | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ
A.pH试纸B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则③的化学方程式是
(3)④中阳极反应产生的气体E为
(4)试写出⑥的离子方程式

请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
A.50mL烧杯;B.50mL量筒;C.100mL量筒;D.25mL酸式滴定管.
(2)①的X可选用(填化学式)
(3)检验沉淀是否已经洗涤干净的操作是
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量W2 g,则样品中铁元素的质量分数是
10(W2-W1)×
| ||
| a |
10(W2-W1)×
| ||
| a |
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图2所示.对图中a点的说法正确的是
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上.
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的c(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和.
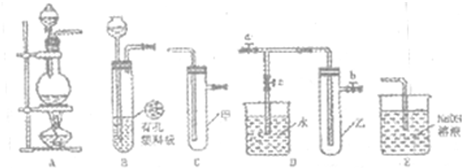
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱.
①选择合理的装置连接:
②选择所需的试剂:
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4?7H2O晶体,设计实验流程如下:
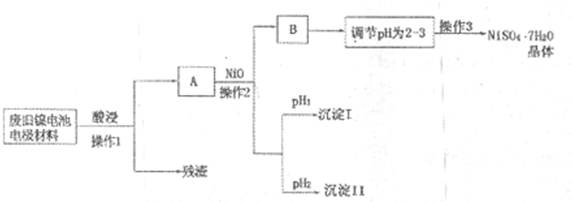
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(1)根据上表数据判断操作2依次析出的沉淀I是
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为
(3)“调节pH为2-3”的目的是
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是

I.请根据上面流程,圆答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2
(3)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是
| 1120(W2-W1) |
| 160a |
| 1120(W2-W1) |
| 160a |
II.有同学提出,还可以采用以下方法来测定:

(4)在量取待测液和滴定过程中需要用到的滴定管是
A.一支酸式滴定管和一支碱式滴定管 B两支酸式滴定管 C两支碱式滴定管
(5)滴定终点的现象为
(6)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是
| 14bc |
| 5a |
| 14bc |
| 5a |
(7)在试验过程中,下列操作可能造成铁元素的质量分数偏高的是
A.溶解样品时用稀盐酸代替稀硫酸
B.用铁单质做还原剂
C.量取滤液时未润洗对应滴定管
D.滴定前读数时满定管内无气泡,滴定后有气泡残留在滴定管尖端
E.配制c mol/L KMnO4标准溶液时未将洗涤液一并转移入容量瓶
F.试验时在锥形瓶中放了25.5mL含有Fe2+的待测液.
(20分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭 土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
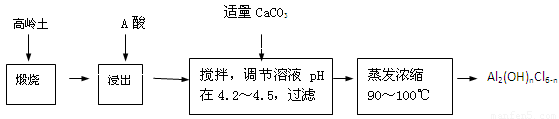
已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有 _______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是___________ ______。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
查看习题详情和答案>>