网址:http://m.1010jiajiao.com/timu3_id_322128[举报]
(10分)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A的离子结构示意图是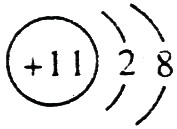 ,C的原子结构示意图是
,C的原子结构示意图是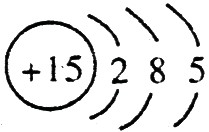 。
。
(2)C的最高价氧化物对应的水化物与A的氢氧化物生成三种盐,化学式分别为Na3PO4、Na2HPO4、NaH2PO4。
(3)C、D的气态氢化物稳定性由强到弱的顺序是 HCl>PH3。
【解析】 最高正价=原子最外层电子数,B元素的原子最外层电子数应为4,B元素原子的次外层电子数为2,为K层,B元素原子核外共有2+4=6个电子,B是6号元素碳;A、C原子次外层电子数为8,则A、C原子核外电子数分别是:2+8+1=11和2+8+5=15,所以A为11号元素钠,C为15号元素磷;在1~18号元素中,最高价为+7的只有氯元素(F无正价),而HClO4是已知含氧酸中最强的酸,故D为氯。
(1)钠总是+1价,其离子结构示意图为: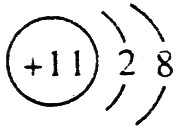 ;磷的原子序数是15,其原子结构示意图是:
;磷的原子序数是15,其原子结构示意图是: 。
。
(2)磷的最高价(+5)氧化物对应的水化物是H3PO4,与NaOH反应生成:Na3PO4、NaH2PO4三种盐。
(3)P、Cl原子都具有3个电子层,核电荷数P(15)小于Cl(17),原子半径r(P)>r(Cl),所以非金属Cl>P,气态氢化物稳定性HCl>PH3。
查看习题详情和答案>>|
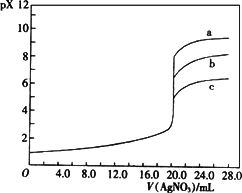
已知25℃时,AgC1、AgBr、Agl的Ksp分别为1.8×10-10、5.0×10-13、8.3×10-17,用AgNO3标准溶液滴定卤素离子的过程,以滴入AgNO3溶液的体积为横坐标,pX为纵坐标:[pX=-lgc(X-)],就可绘得滴定曲线.现以0.1 mol·L-1 AgNO3溶液分别滴定20.00 mL 0.1 mol·L-1 Cl-、Br-、I-绘得滴定曲线如图,下列有关说法中正确的是
| |
| [ ] | |
A. |
a、b、c分别表示Cl-、Br-、I- |
B. |
a、b、c分别表示I-、Br-、Cl- |
C. |
a、b、c分别表示Br-、I-、Cl- |
D. |
用硝酸银滴定法测定试样中c(Cl-),可用KI作指示剂 |
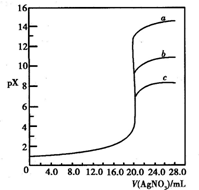 用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示: 用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示:
|
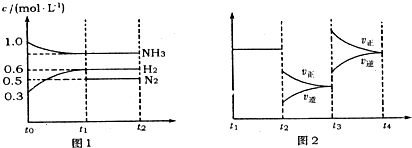
(1)能证明反应达到平衡状态的是
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t0-t1阶段以H2浓度变化表示的反应速率为
(3)t3-t4阶段改变的条件为
(4)上述反应的平衡常数K=
(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb=
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |