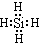题目内容
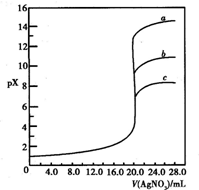 用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示: 用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示:
|
分析:A、依据Ksp计算转化为氯化银和铬酸银需要的银离子浓度判断先沉淀的是氯化银分析判断,K2CrO4为指示剂,Ag2CrO4为砖红色,用标准硝酸银滴定待测液,滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀;
B、依据溶度积常数大小比较先沉淀的是碘离子;
C、依据沉淀转化,结合溶度积常数分析计算
D、依据碘化银的溶度积常数计算.
B、依据溶度积常数大小比较先沉淀的是碘离子;
C、依据沉淀转化,结合溶度积常数分析计算
D、依据碘化银的溶度积常数计算.
解答:解:A、由Ksp(AgCl)=1.56ⅹ10-10,Ksp(Ag2CrO4)=1.10ⅹ10-12,
转化为AgCl沉淀需要的c(Ag+)=
=1.4×10-5mol/L,
转化为Ag2CrO4沉淀需要的c(Ag+)=
mol/L>1.4×10-5mol/L,
即AgCl先转化为沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉,说明反应达到终点,故A正确;
B、用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,依据溶度积常数分析,Ksp越小的先沉淀,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],浓度越大PX越小,所以滴定终点剩余的氯离子浓度大于溴离子大于碘离子,曲线abc为I-、Br-、Cl-的曲线,故B错误;
C、向NaCl和NaBr的混合溶液中滴加硝酸银溶液,当两种沉淀共存时,银离子浓度相同,形成沉淀转化平衡,AgCl+Br-=AgBr+Cl-,Ksp=
=
=
,则
=2.7×10-3,故C正确;
D、,当pX=13时,c(I-)=10-13mol/L,Ksp=8.3×10-17,依据Ksp计算得到溶液中c(Ag+)=8.3×10-4 mol/L,故D正确;
故选B.
转化为AgCl沉淀需要的c(Ag+)=
| 1.56×10-10 |
转化为Ag2CrO4沉淀需要的c(Ag+)=
| 3 | 2×1.10×10-12 |
即AgCl先转化为沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉,说明反应达到终点,故A正确;
B、用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,依据溶度积常数分析,Ksp越小的先沉淀,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],浓度越大PX越小,所以滴定终点剩余的氯离子浓度大于溴离子大于碘离子,曲线abc为I-、Br-、Cl-的曲线,故B错误;
C、向NaCl和NaBr的混合溶液中滴加硝酸银溶液,当两种沉淀共存时,银离子浓度相同,形成沉淀转化平衡,AgCl+Br-=AgBr+Cl-,Ksp=
| c(Cl-) |
| c(Br-) |
| Ksp(AgCl) |
| Ksp(AgBr) |
| 2×10-10 |
| 5.4×10-13 |
| c(Br-) |
| c(Cl-) |
D、,当pX=13时,c(I-)=10-13mol/L,Ksp=8.3×10-17,依据Ksp计算得到溶液中c(Ag+)=8.3×10-4 mol/L,故D正确;
故选B.
点评:本题考查沉淀溶解平衡的分析判断,溶度积常数的计算应用,题目难度较大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列图象表达正确的是( )
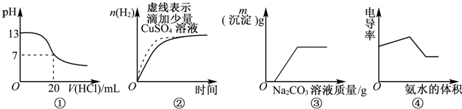

| A、图①表示25℃时,用0.1mol?L-1盐酸滴定20mL 0.1mol?L-1氨水 | B、图②表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 | C、图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | D、图④表示向醋酸溶液中滴入氨水 |
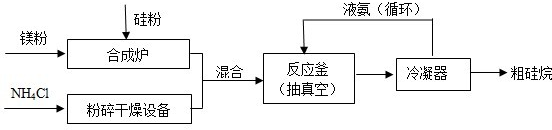
 (2013?海淀区二模)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业.为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
(2013?海淀区二模)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业.为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜: