摘要:34.硫酸铜晶体常用作农业和渔业的杀虫剂.杀菌剂.以下是由废铜料生产硫酸铜晶体的流程. (1) B的化学式为 .操作a的名称是 . (2)反应①.③的化学方程式分别为 ① ,③ . (3)已知:Cu+2H2SO4 (浓) CuSO4+ SO2↑+2H2O.从环保和经济的角度分析.对比途径I.Ⅱ.途径I的优点有: .
网址:http://m.1010jiajiao.com/timu3_id_31986[举报]
硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程
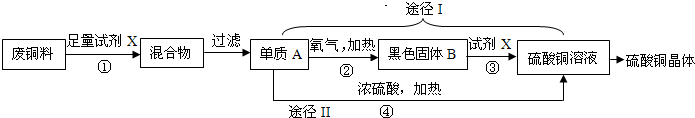
(1)反应①的化学方程式为 .
(2)途径I中,反应②、③的化学方程式分别为② ,③ ;途径Ⅱ中,反应④的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,利用途径 (选填“I”或“Ⅱ”)制取硫酸铜的方案更合理.
(3)某化学兴趣小组同学用足量铜与10g质量分数为98%的浓硫酸在加热条件下充分反应,生成SO2的质量应 (选填字母).
A.等于3.2g B.小于3.2g C.大于3.2g
(4)该化学兴趣小组同学通过查阅资料,发现大多数金属与浓硫酸都能发生反应.现取足量锌与浓硫酸反应,其化学方程式为:Zn+2H2SO4(浓)═ZnSO4+SO2↑+2H2O.反应一段时间后,老师指出除了SO2,还可能生成另一种气体.请你根据锌的化学性质,推断此气体可能是 ,理由是 .
查看习题详情和答案>>

(1)反应①的化学方程式为
(2)途径I中,反应②、③的化学方程式分别为②
| ||
(3)某化学兴趣小组同学用足量铜与10g质量分数为98%的浓硫酸在加热条件下充分反应,生成SO2的质量应
A.等于3.2g B.小于3.2g C.大于3.2g
(4)该化学兴趣小组同学通过查阅资料,发现大多数金属与浓硫酸都能发生反应.现取足量锌与浓硫酸反应,其化学方程式为:Zn+2H2SO4(浓)═ZnSO4+SO2↑+2H2O.反应一段时间后,老师指出除了SO2,还可能生成另一种气体.请你根据锌的化学性质,推断此气体可能是
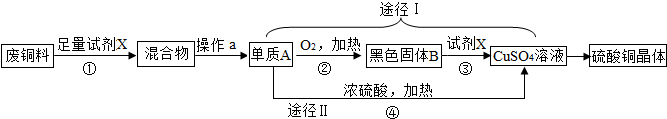
硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.以下是由废铜料(含铁)生
产硫酸铜晶体的流程.
(1)该流程中制得的硫酸铜溶液能否用铁桶来盛装? (填“能”或“不能”)
(2)操作a的名称是 .固体B的化学式为 .
(3)在反应①中加入的试剂X要“足量”的原因 ;
(4)在反应④中,单质A和浓硫酸反应时还生成了一种带刺激性气味的有害气体,写出④的化学反应方程式 .从环保和经济的角度分析,对比途径I,Ⅱ,途径I的优点有:不产生有害气体和 .
 查看习题详情和答案>>
查看习题详情和答案>>
产硫酸铜晶体的流程.
(1)该流程中制得的硫酸铜溶液能否用铁桶来盛装?
(2)操作a的名称是
(3)在反应①中加入的试剂X要“足量”的原因
(4)在反应④中,单质A和浓硫酸反应时还生成了一种带刺激性气味的有害气体,写出④的化学反应方程式
 查看习题详情和答案>>
查看习题详情和答案>>
硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程.

(1)B的化学式为 ,操作a的名称是 .
(2)②的反应基本类型为 ;反应①、③的化学方程式分别为① ;③ .
(3)已知:Cu+2H2SO4 (浓)
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和 .
查看习题详情和答案>>

(1)B的化学式为
(2)②的反应基本类型为
(3)已知:Cu+2H2SO4 (浓)
| ||

