题目内容
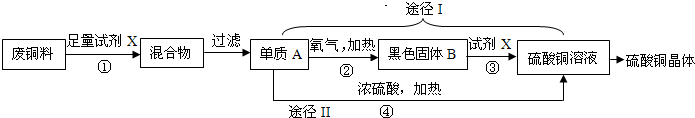
硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程.
(1)B的化学式为
(2)②的反应基本类型为
(3)已知:Cu+2H2SO4 (浓)
| ||
分析:(1)根据流程图可推断,黑色固体B应是铜在加热条件下与氧气反应的产物;单质A为不与试剂X稀硫酸反应的铜,因此,操作a是把不溶性固体和溶液分离开的操作;
(2)反应②为金属单质铜与氧气在加热条件下所发生的反应,生成黑色固体氧化铜,两种物质生成一种物质的反应;反应①为使用稀硫酸把铁反应而除去的置换反应;反应③则应是黑色固体氧化铜与稀硫酸得到硫酸而发生的复分解反应;
(3)途径II中产生二氧化硫气体不但会产生污染,而且会使部分硫酸因转化成二氧化硫而造成转化率不高,
(2)反应②为金属单质铜与氧气在加热条件下所发生的反应,生成黑色固体氧化铜,两种物质生成一种物质的反应;反应①为使用稀硫酸把铁反应而除去的置换反应;反应③则应是黑色固体氧化铜与稀硫酸得到硫酸而发生的复分解反应;
(3)途径II中产生二氧化硫气体不但会产生污染,而且会使部分硫酸因转化成二氧化硫而造成转化率不高,
解答:解:
(1)黑色固体为金属铜在加热条件下与氧气化合产生的氧化铜;操作a为过滤操作,把不与稀硫酸反应的金属铜与硫酸亚铁溶液分离开来;
故答案为:CuO;过滤;
(2)反应②,加热条件下金属铜与氧气化合生成氧化铜;反应①则是铁与稀硫酸反应生成硫酸亚铁和氢气;反应③为黑色氧化铜与稀硫酸反应生成硫酸铜和水;
故答案为:化合反应;Fe+H2SO4=FeSO4+H2↑;CuO+H2SO4=CuSO4+H2O;
(3)途径II产生的二氧化硫既会污染环境,又使硫酸不能全部转化为产品硫酸铜而形成浪费;
故答案为:硫酸的利用率高.
(1)黑色固体为金属铜在加热条件下与氧气化合产生的氧化铜;操作a为过滤操作,把不与稀硫酸反应的金属铜与硫酸亚铁溶液分离开来;
故答案为:CuO;过滤;
(2)反应②,加热条件下金属铜与氧气化合生成氧化铜;反应①则是铁与稀硫酸反应生成硫酸亚铁和氢气;反应③为黑色氧化铜与稀硫酸反应生成硫酸铜和水;
故答案为:化合反应;Fe+H2SO4=FeSO4+H2↑;CuO+H2SO4=CuSO4+H2O;
(3)途径II产生的二氧化硫既会污染环境,又使硫酸不能全部转化为产品硫酸铜而形成浪费;
故答案为:硫酸的利用率高.
点评:根据生产流程图,正确理解每个过程在生产中的作用,从而达到全面掌握生产过程的目的,为解答问题做足准备.

练习册系列答案
相关题目