摘要:17 2Fe-4e-=2Fe2+ O2+4e-+2H2O=4OH- C; 负18. 2H+ + 2e- = H2 溶液变红 2.24 用湿润的淀粉碘化钾试纸靠近Y极开口处.试纸变蓝.说明有CI2生成. 2NaCl + 2H2O === 2NaOH + Cl2 + H2 CuSO4 Fe Cu - 2 e- == Cu 2+ 25.6
网址:http://m.1010jiajiao.com/timu3_id_315935[举报]
|
我国首创的铝-空气-海水电池被称为“海洋电池”,是一种无污染的长效电池,以铁铂合金网(接触空气)和铝分别为电池的两极放入海水中即可供电,下列反应与该电池的工作原理有关的是 ①Fe-2e- | |
A. |
②③④ |
B. |
①③⑤ |
C. |
①⑤ |
D. |
③④ |
海边的铁制品比较容易生锈,月球上的铁不易腐蚀。钢铁发生腐蚀时,正极上发生的反应为( )
- A.2Fe-4e-===2Fe2+
- B.2Fe2++4e-===2Fe
- C.2H2O+O2+4e-===4OH-
- D.2Fe3++2e-===2Fe2+
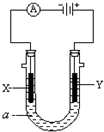 Ⅰ.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,请回答:
Ⅰ.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,请回答:(1)X极上的电极反应式:
2H++2e-=H2↑
2H++2e-=H2↑
.在X极附近观察到的现象是放出气体,溶液变红
放出气体,溶液变红
.(2)Y电极上的电极反应式为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,检验该电极反应产物的方法是把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
.Ⅱ.三峡大坝使万里长江变成黄金水道,但三峡船闸的防腐蚀是现实而又紧迫的任务,请你分析:
(1)船闸主要发生的是
吸氧
吸氧
腐蚀,并请写出腐蚀的电极反应式:负极:
2Fe-4e-=2Fe2+
2Fe-4e-=2Fe2+
;正极:O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(2)请你对三峡船闸的防腐蚀提出一项合理化建议:
及时刷油漆,保护钢铁不与空气和水接触;
及时刷油漆,保护钢铁不与空气和水接触;
或在船闸上镶嵌锌块并及时补充;或将直流电源的负极焊接到船闸上,并不间断供电
或在船闸上镶嵌锌块并及时补充;或将直流电源的负极焊接到船闸上,并不间断供电
.(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中,该原电池的负极是
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示)
查看习题详情和答案>>
Fe
Fe
,负极反应式为2Fe-4e-═2Fe2+
2Fe-4e-═2Fe2+
;正极是C
C
,正极反应式为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示)
(3)(4)
(3)(4)
.
 在下列几种简单的原电池中,按要求填空:
在下列几种简单的原电池中,按要求填空:(1)将锌、铜用导线连接后共同浸入2mol/L的稀硫酸中,正极电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
,发生还原
还原
反应(填氧化或还原);电子从锌
锌
经外电路到铜
铜
(填锌或铜),溶液中H+向正极
正极
移动(填正极或负极),放电一段时间后,正极区pH值变大
变大
(填变大、变小或不变).(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表.画出该电池结构的示意图,在图上标出正、负极,电解质和电子流向
写出负极电极反应式为
Cu-2e-=Cu2+
Cu-2e-=Cu2+
,总反应的离子方程式为
Cu+2Fe3+=Cu2++2Fe2+
Cu+2Fe3+=Cu2++2Fe2+
.(3)将铁片和石墨电极用导线连接后插入氯化钠溶液中,也有电流通过电流表,请写出负极电极反应式
2Fe-4e-=2Fe2+
2Fe-4e-=2Fe2+
,正极电极反应式为O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.