题目内容
 在下列几种简单的原电池中,按要求填空:
在下列几种简单的原电池中,按要求填空:(1)将锌、铜用导线连接后共同浸入2mol/L的稀硫酸中,正极电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
,发生还原
还原
反应(填氧化或还原);电子从锌
锌
经外电路到铜
铜
(填锌或铜),溶液中H+向正极
正极
移动(填正极或负极),放电一段时间后,正极区pH值变大
变大
(填变大、变小或不变).(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表.画出该电池结构的示意图,在图上标出正、负极,电解质和电子流向
写出负极电极反应式为
Cu-2e-=Cu2+
Cu-2e-=Cu2+
,总反应的离子方程式为
Cu+2Fe3+=Cu2++2Fe2+
Cu+2Fe3+=Cu2++2Fe2+
.(3)将铁片和石墨电极用导线连接后插入氯化钠溶液中,也有电流通过电流表,请写出负极电极反应式
2Fe-4e-=2Fe2+
2Fe-4e-=2Fe2+
,正极电极反应式为O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.分析:(1)根据原电池工作原理分析;
(2)根据正负极的电极反应类型确定电极反应式;
(3)根据铁的吸氧腐蚀书写电极反应式;
(2)根据正负极的电极反应类型确定电极反应式;
(3)根据铁的吸氧腐蚀书写电极反应式;
解答:解:(1)该原电池中锌是负极,铜是正极,正极上氢离子得电子生成氢气,发生还原反应;外电路上,电子从负极沿导线到正极,所以电子是从锌经外电路到铜;铜极附近有大量的电子,根据异性电荷相吸,铜极吸引氢离子,所以氢离子向正极移动;正极上氢离子得电子生成氢气,所以氢离子浓度降低,PH值变大.
故答案为:2H++2e-=H2↑; 还原; 锌; 铜; 正极; 变大.
(2)铁是负极,铜是正极,氯化铁是电解质,电子从负极(铁极)沿导线到正极(铜极).负极上铁失电子生成二价铁离子,正极上三价铁离子得电子生成二价铁离子,正负极上电极反应式相加得电池反应方程式.
故答案为:
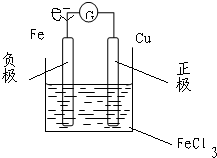
Cu-2e-=Cu2+; Cu+2Fe3+=Cu2++2Fe2+;
(3)铁作负极,石墨作正极,溶液中溶有一定量的氧气,所以负极上铁失电子生成二价铁离子,正极上氧气和水得电子生成氢氧根离子.
故答案为:(-):2Fe-4e-=2Fe2+; (+):O2+4e-+2H2O=4OH-
故答案为:2H++2e-=H2↑; 还原; 锌; 铜; 正极; 变大.
(2)铁是负极,铜是正极,氯化铁是电解质,电子从负极(铁极)沿导线到正极(铜极).负极上铁失电子生成二价铁离子,正极上三价铁离子得电子生成二价铁离子,正负极上电极反应式相加得电池反应方程式.
故答案为:

Cu-2e-=Cu2+; Cu+2Fe3+=Cu2++2Fe2+;
(3)铁作负极,石墨作正极,溶液中溶有一定量的氧气,所以负极上铁失电子生成二价铁离子,正极上氧气和水得电子生成氢氧根离子.
故答案为:(-):2Fe-4e-=2Fe2+; (+):O2+4e-+2H2O=4OH-
点评:根据电极材料的活泼性判断正负极,根据正极极上得失电子确定电极反应式的类型书写.

练习册系列答案
相关题目