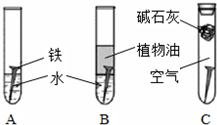
题目内容
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中,该原电池的负极是
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示)
Fe
Fe
,负极反应式为2Fe-4e-═2Fe2+
2Fe-4e-═2Fe2+
;正极是C
C
,正极反应式为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示)
(3)(4)
(3)(4)
.
分析:(1)钢铁混有少量的碳杂质,在潮湿的空气中容易形成原电池,中性或弱酸性条件下,钢铁发生吸氧腐蚀,酸性环境下,钢铁发生析氢腐蚀,无论析氢腐蚀、还是吸氧腐蚀,负极上都是铁失电子发生氧化反应,析氢腐蚀,正极上氢离子得电子发生还原反应,吸氧腐蚀正极上氧气得电子发生还原反应;
(2)装置为原电池锌做负极被腐蚀,铁做正极被保护;装置为电解池,铁做阴极被保护;
(2)装置为原电池锌做负极被腐蚀,铁做正极被保护;装置为电解池,铁做阴极被保护;
解答:解:(1)钢铁在空气酸度不大的环境中,形成原电池发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应,负极上铁电极反应式为:2Fe-4e-═2Fe2+,正极碳上氧气得电子发生还原反应,电极反应式为:O2+2H20+4e-═40H-,
故答案为:Fe;2Fe-4e-═2Fe2+;C;O2+2H2O+4e-═4OH-;
(2)(1)该装置铁未作任何保护,故不选;
(2)该装置为原电池,铁的金属活动性比锡强,铁为原电池的负极,铁腐蚀得更快,故不选;
(3)该装置为原电池锌做负极被腐蚀,铁做正极被保护,故选;
(4)该装置为电解池,铁做阴极被保护,故选;
(5)该装置为电解池,铁做阳极腐蚀得更快,故不选;
故答案为:(3)(4);
故答案为:Fe;2Fe-4e-═2Fe2+;C;O2+2H2O+4e-═4OH-;
(2)(1)该装置铁未作任何保护,故不选;
(2)该装置为原电池,铁的金属活动性比锡强,铁为原电池的负极,铁腐蚀得更快,故不选;
(3)该装置为原电池锌做负极被腐蚀,铁做正极被保护,故选;
(4)该装置为电解池,铁做阴极被保护,故选;
(5)该装置为电解池,铁做阳极腐蚀得更快,故不选;
故答案为:(3)(4);
点评:本题考查了电化学有关知识,作原电池负极或电解池阳极的金属易被腐蚀,明确原电池的工作原理、掌握金属腐蚀原理是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目