摘要:已知2I- + 2Fe3+ = I2 + 2Fe2+.某强酸性溶液中可能存在NO3- .Cl- .I- .Fe3+ 中的一种或几种,向该溶液中加入溴水,单质溴被还原,由此推断该溶液中 A.不含NO3-,也不含Fe3+. B.含有NO3- I- Cl- C.含I-但不能确立是否含NO3- D.含有Fe3+
网址:http://m.1010jiajiao.com/timu3_id_315034[举报]
(2010?和平区一模)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
问题1 工业生产碘酸钾的流程如下:
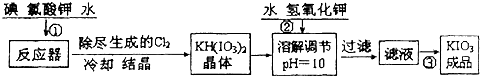
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同.请写出反应器中发生反应的化学方程式:
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是
问题2 已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2
=2I-+S4
.
(1)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是
mg/kg(以含w的代数式表示).
(2)学生乙又进行了下列实验:
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示
②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:
其原因是
查看习题详情和答案>>
问题1 工业生产碘酸钾的流程如下:

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同.请写出反应器中发生反应的化学方程式:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
;(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是
蒸发结晶
蒸发结晶
.| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
| O | 2- 3 |
| O | 2- 6 |
(1)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是
| 1270 |
| 3W |
| 1270 |
| 3W |
(2)学生乙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
4I-+4H++O2=2I2+2H2O
4I-+4H++O2=2I2+2H2O
.②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:
偏大
偏大
(填“偏大”、“偏小”或“正确”).其原因是
过量的I-会被空气中的O2氧化为I2
过量的I-会被空气中的O2氧化为I2
.加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为 .
(2)参照碘酸钾的溶解度:
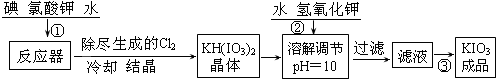
操作③得到碘酸钾晶体,方法是 .
已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O;
I2+2S2O32-→2I-+S4O62-.
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应.用四氯化碳检验碘单质时,看到的明显现象有 .
(4)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
③以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示).
(5)学生丙又对纯净的NaCl进行了下列实验:
请推测实验中产生蓝色现象的可能原因,用离子方程式表示 ;
根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: (填“偏高”、“偏低”或“准确”)并说明原因 .
查看习题详情和答案>>
工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为
(2)参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |

操作③得到碘酸钾晶体,方法是
已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O;
I2+2S2O32-→2I-+S4O62-.
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应.用四氯化碳检验碘单质时,看到的明显现象有
(4)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
③以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
则加碘食盐样品中的碘元素含量是
(5)学生丙又对纯净的NaCl进行了下列实验:
| 操 作 步 骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:
进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡.
(1)25℃时,已知胃液的pH在0.9-1.5之间,请问
(2)当人体中Ba2+浓度达到2×10-3mol?L-1时,就会对健康产生危害,若误将氯化钡当做食盐使用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol?L-1)有效除去胃中的Ba2+.(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
(3)环境监测某工厂废水中Ba2+的浓度.取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol?L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL.已知有关的离子方程式为:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-=2I-+S4O62-.
试计算该工厂废水中Ba2+的物质的量浓度.
查看习题详情和答案>>
(1)25℃时,已知胃液的pH在0.9-1.5之间,请问
不能
不能
(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由:BaCO3会与胃酸反应产生Ba2+使人中毒
BaCO3会与胃酸反应产生Ba2+使人中毒
.(2)当人体中Ba2+浓度达到2×10-3mol?L-1时,就会对健康产生危害,若误将氯化钡当做食盐使用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol?L-1)有效除去胃中的Ba2+.(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
BaSO4(s) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
C(Ba2+)=1.1×10-10/0.36=3.1×10-10<2×10-3mol?L-1
可以有效除去Ba2+(
 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)C(Ba2+)=1.1×10-10/0.36=3.1×10-10<2×10-3mol?L-1
可以有效除去Ba2+(
BaSO4(s) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
C(Ba2+)=1.1×10-10/0.36=3.1×10-10<2×10-3mol?L-1
可以有效除去Ba2+(
. Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)C(Ba2+)=1.1×10-10/0.36=3.1×10-10<2×10-3mol?L-1
可以有效除去Ba2+(
(3)环境监测某工厂废水中Ba2+的浓度.取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol?L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL.已知有关的离子方程式为:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-=2I-+S4O62-.
试计算该工厂废水中Ba2+的物质的量浓度.
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.已知:2I-+Cl2=I2+2Cl-;实验室里从海藻中提取碘的流程如图1所示:
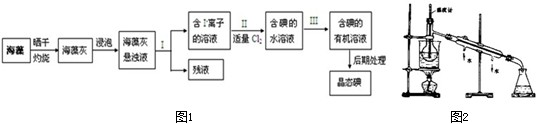
(1)指出提取碘的过程中有关的实验操作名称:I ,III ;
(2)现用CCl4从含碘的水溶液中提取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧怀接收溶液
F.从分液漏斗上口倒出上层水溶液
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔
H.静置,分层
就此实验,完成下列填空:
①正确操作步骤的顺序是 → → →A→G→ →E→F (用上述各操作的编号字母填写).
②上述(G)步骤操作的目的是 .
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏.指出如图2所示实验装置中的错误之处(不必填满):
① ,
② ,
③ .
(4)进行上述蒸馏实验操作时,使用水浴的原因是 ,最后晶态碘在 里聚集.
查看习题详情和答案>>

(1)指出提取碘的过程中有关的实验操作名称:I
(2)现用CCl4从含碘的水溶液中提取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧怀接收溶液
F.从分液漏斗上口倒出上层水溶液
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔
H.静置,分层
就此实验,完成下列填空:
①正确操作步骤的顺序是
②上述(G)步骤操作的目的是
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏.指出如图2所示实验装置中的错误之处(不必填满):
①
②
③
(4)进行上述蒸馏实验操作时,使用水浴的原因是