题目内容
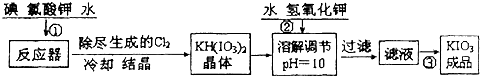
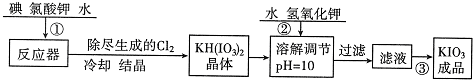
工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为
(2)参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
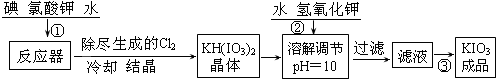
操作③得到碘酸钾晶体,方法是
已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O;
I2+2S2O32-→2I-+S4O62-.
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应.用四氯化碳检验碘单质时,看到的明显现象有
(4)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
③以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
则加碘食盐样品中的碘元素含量是
(5)学生丙又对纯净的NaCl进行了下列实验:
| 操 作 步 骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:
(2)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得晶体需要蒸发结晶;
(3)根据KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O可知,反应生成了碘单质,碘单质易溶于有机溶剂,四氯化碳不溶于水且密度大于水,据此分析用四氯化碳检验碘单质时观察到的现象;
(4)根据硫代硫酸钠与碘酸钾的关系式计算碘酸钾的物质的量,再根据质量分数公式计算碘的含量;
(5)酸性条件下,碘离子被氧气氧化生成碘单质;过量的碘离子易被空气氧化生成碘单质.
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得KIO3晶体需要蒸发结晶,
故答案为:蒸发结晶;
(3)由于碘单质易溶于四氯化碳,所以用四氯化碳检验碘单质时,混合液分层,下层为四氯化碳层,由于萃取了碘单质,下层液体的颜色为紫红色,
故答案为:液体分层,下层液体呈现紫红色;
(4)设碘酸钾的物质的量为x,根据反应KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O、I2+2S2O3 2-=2I-+S4 O62-可得关系式:KIO3~3I2~6S2O3 2-,
则 KIO3~3I2~6S2O3 2-,
1 6
x 2.0×10-3mol/L×0.01L
x=
| 2.0×10-3mol/L×0.01L×1 |
| 6 |
| 1 |
| 3 |
| 1 |
| 3 |
| 127 |
| 3 |
所以碘元素的质量分数为:
| ||
| w×10-3kg |
| 1270 |
| 3w |
故答案为:
| 1270 |
| 3w |
(5)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O;
且酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,
故答案为:4I-+4H++O2→2I2+2H2O;学生乙实验结果会偏大;过量的I-会被空气中的氧气氧化为I2.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
【问题2】已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
① 请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
② 根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。