网址:http://m.1010jiajiao.com/timu3_id_314717[举报]
 [化学-物质结构与性质]
[化学-物质结构与性质]第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
(1)①H、C、N、O四种元素的电负性由小到大的顺序为
②下列叙述不正确的是
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4-中不存在
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
并写出一种与CN_互为等电子体的单质分子式
③三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁的晶体类型为
(3)①Ti的在周期表中位置
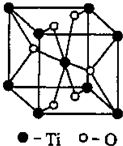
②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 ____________。
②下列叙述不正确的是____________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个
 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子 D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式____________。
(2) Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是_____________
②六氰合亚铁离子[Fe(CN)6]4 -中不存在_______________。
A、共价键 B、非极性键 C、配位键 D、σ键 E、π键
写出一种与 CN- 互为等电子体的单质分子式______________。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于_________ 区。
(4)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:

② 若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为_______________cm。

请回答下列问题:
(1)A的分子式为
(2)D分子含有的官能团是
(3)上述转换关系的化学方程式中,属于水解反应的有
(4)写出化学方程式:
①A和稀硫酸共热:
| 稀硫酸 |
| △ |
| 稀硫酸 |
| △ |
②E氧化成G:
| △ |
| △ |
③F与氢氧化钠醇溶液共热:
| 醇 |
| △ |
| 醇 |
| △ |
(5)与B互为同分异构体的且属于链状酯的物质共有
一种名为“苹果醋(ACV)”的浓缩饮料多年来风靡全美.ACV是一种由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效.苹果酸是这种饮料的主要酸性物质,分离提纯后对苹果酸的分析如下:
(1)其相对分子质量不超过140;
(2)元素分析证明仅含C、H、O三种元素,各元素的质量分数为C:35.82%,H:4.48%,其余为O元素;
(3)0.001mol苹果酸与足量NaHCO3反应放出44.8mLCO2,若等量该酸与足量金属Na在一定条件下充分反应则放出33.6mLH2(气体体积均已经折算为标准状况);
(4)结构分析表明,苹果酸中所有碳原子在一条主链上.
回答下列问题:
①苹果酸的分子式为:________;
②写出苹果酸在一定条件下分子内脱水得到的链状产物的结构简式:________,该产物中含有的官能团的名称是:________,该反应的类型属于:________;苹果酸在一定条件下进行分子内脱水时是否还能得到其他可能的产物,有的话请写出其产物的任意一种结构简式,没有其他产物则此问不填:________;
③写出苹果酸一定条件下与足量Na反应的化学方程式:________;
④写出苹果酸与碳酸氢钠溶液反应的化学方程式:________.
| |||||||||||||||||||