网址:http://m.1010jiajiao.com/timu3_id_310620[举报]
①0.1 mol·L-1 NH3·H2O溶液 ②0.1 mol·L-1 NH4Cl溶液
(1)溶液①的pH__ 7(填“>”“<”或“=”);
(2)溶液②呈____性(填“酸”“碱”或“中”),升高温度可以____(填“促进”或“抑制”)NH4Cl的水解;
(3)关于两种溶液中c(NH4+)的大小叙述正确的是____(填序号)。
a.两种溶液中c(NH4+)都等于0.1 mol·L-1
b.两种溶液中c(NH4+)都小于0.1mol·L-1
c.NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是
③根据该反应特点,此反应自发进行的条件是
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:
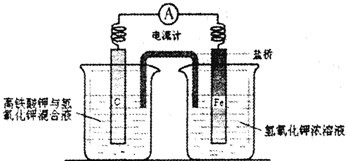
已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是
②若该电池属于二次电池,则充电时阴极反应的电极反应式为
已知Cl2、Al2(SO4)3、CaC2、C2H5Br,![]() 等物质均能与水发生反应,反应中各物质和水分别分离成两部分,然后两两重新组成形成新的物质.今有下列五种物质,常温下很容易与水发生反应:
等物质均能与水发生反应,反应中各物质和水分别分离成两部分,然后两两重新组成形成新的物质.今有下列五种物质,常温下很容易与水发生反应:
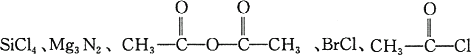 ,试问:
,试问:
(1)在后面所给的五种物质与水反应的产物中,属于最高价氧化物的水化物的是________,属于无氧酸的是________.
(2)分别将0.01 mol的这五种物质放入0.1 L水中反应,结果使溶液的pH值接近3的原物质是:________.
(3)根据水解原理写出下列物质与水反应的化学方程式:
①NH4Cl________________.
②Mg2C3________________________.
当今水体的污染成为人们关注的焦点.利用化学原理可以对工厂排放的废水进行有效检测与合理处理.
(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol?L-1时,溶液中c(PO43-)=______mol?L-1.
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石--鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为______;与方法一相比,方法二的优点为______.
(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体.现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为______.
(3)工业上也会利用铝粉除去含氮废水中的NO3-.现在处理100m3浓度为2.0×10-4mol?L-1的NaNO3溶液,加入一定量的2mol?L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4:1,求此过程中消耗铝的质量.(写出计算过程,无过程以0分计算)
查看习题详情和答案>>
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。