题目内容
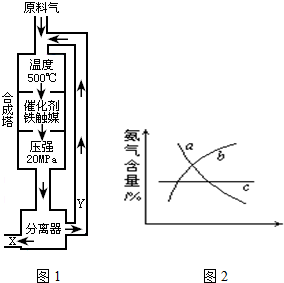
(1)如图1,横坐标为溶液的pH,纵标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全).试回答下列问题:

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
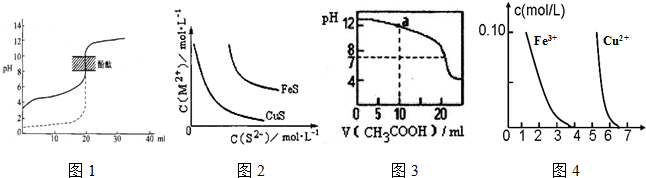
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是 ,最小的是 .
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是 ,曲线Ⅱ对应的实验改变的条件是 .
③根据该反应特点,此反应自发进行的条件是 (填“高温”、“低温”或“任何温度”).
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:
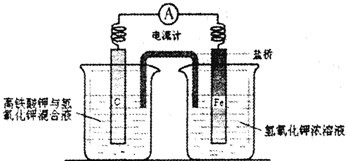
已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是 .
②若该电池属于二次电池,则充电时阴极反应的电极反应式为 .

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是
③根据该反应特点,此反应自发进行的条件是
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:

已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是
②若该电池属于二次电池,则充电时阴极反应的电极反应式为
分析:(1)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀;
②根据Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)计算.
(2)根据电离常数Ka=
计算;
(3)①单位时间氢气的物质的量的变化量越大,表明平均速率越大,单位时间氢气的物质的量的变化量越小,平均反应速率越小.
②由图2可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动;
曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动;
结合反应的特征进行分析;
③反应自发进行的判断依据是:△H-T?△S<0,据此分析;
(4)①FeO42-在正极得电子生成Fe3+;
②充电时Fe(OH)3在阴极得电子生成Fe.
②根据Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)计算.
(2)根据电离常数Ka=
| c(H+)?c(A-) |
| c(HA) |
(3)①单位时间氢气的物质的量的变化量越大,表明平均速率越大,单位时间氢气的物质的量的变化量越小,平均反应速率越小.
②由图2可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动;
曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动;
结合反应的特征进行分析;
③反应自发进行的判断依据是:△H-T?△S<0,据此分析;
(4)①FeO42-在正极得电子生成Fe3+;
②充电时Fe(OH)3在阴极得电子生成Fe.
解答:解:(1)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀,溶液中存在的金属阳离子为Cu2+、Fe2+,
故答案为:Cu2+、Fe2+;
②由图象可知:c(Fe2+)=1.0×10-5(mol?L-1),c(OH-)=1.0×10-6(mol?L-1)
Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)=1.0×10-17(mol?L-1)3,
故答案为:1.0×10-17(mol?L-1)3.
(2)HA?A-+H+
起始(mol/L):0.1 0 0
变化(mol/L):10-3 10-3 10-3
平衡(mol/L):0.1-10-3 10-3 10-3
电离程度Ka=
=
≈10-5,
电离常数(Ka)=10-5.
故答案为:10-5mol?L-1;
(3)①A.由图2可知,0~1min内氢气的变化量为8mol-6mol=2mol;
B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol;
C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;
D.8~11min达平衡状态,氢气的物质的量不再变化.
故0~1min速率最大,8~11min速率最小.
故答案为:A;D.
②对于可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,正反应是体积减小的放热反应.
由图2可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度.
曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度.
故答案为:升高温度;增大压强或者是增大CO2浓度;
③反应自发进行的判断依据是:△H-T?△S<0,已知CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,由反应可知该反应为熵减小的反应,
若要△H-T?△S<0,则需在低温条件下进行,
故答案为:低温;
(4)①FeO42-在正极得电子生成Fe3+,其电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;
故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;
②充电时Fe(OH)3在阴极得电子生成Fe,其电极反应式为:Fe(OH)3+3e-═Fe+3OH-,
故答案为:Fe(OH)3+3e-═Fe+3OH-.
故答案为:Cu2+、Fe2+;
②由图象可知:c(Fe2+)=1.0×10-5(mol?L-1),c(OH-)=1.0×10-6(mol?L-1)
Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)=1.0×10-17(mol?L-1)3,
故答案为:1.0×10-17(mol?L-1)3.
(2)HA?A-+H+
起始(mol/L):0.1 0 0
变化(mol/L):10-3 10-3 10-3
平衡(mol/L):0.1-10-3 10-3 10-3
电离程度Ka=
| c(H+)?c(A-) |
| c(HA) |
| 10-3×10-3 |
| 0.1-10-3 |
电离常数(Ka)=10-5.
故答案为:10-5mol?L-1;
(3)①A.由图2可知,0~1min内氢气的变化量为8mol-6mol=2mol;
B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol;
C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;
D.8~11min达平衡状态,氢气的物质的量不再变化.
故0~1min速率最大,8~11min速率最小.
故答案为:A;D.
②对于可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,正反应是体积减小的放热反应.
由图2可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度.
曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度.
故答案为:升高温度;增大压强或者是增大CO2浓度;
③反应自发进行的判断依据是:△H-T?△S<0,已知CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,由反应可知该反应为熵减小的反应,
若要△H-T?△S<0,则需在低温条件下进行,
故答案为:低温;
(4)①FeO42-在正极得电子生成Fe3+,其电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;
故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;
②充电时Fe(OH)3在阴极得电子生成Fe,其电极反应式为:Fe(OH)3+3e-═Fe+3OH-,
故答案为:Fe(OH)3+3e-═Fe+3OH-.
点评:本题考查化学平衡图象、反应速率大小判断、外界条件对平衡的影响,原电池、电解池等,题目难度较大,注意图象2中利用“先拐先平”,即曲线先折拐的首先达到平衡,以此判断温度或压强的高低,再依据外界条件对平衡的影响解答.

练习册系列答案
相关题目
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: (2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
(2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )