摘要:19.[05眉山]你认为化学学科不涉及的研究领域是( ) A.合成新物质 B.寻找新能源 C.治理环境污染 D.物体的运动形式
网址:http://m.1010jiajiao.com/timu3_id_3100[举报]
氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
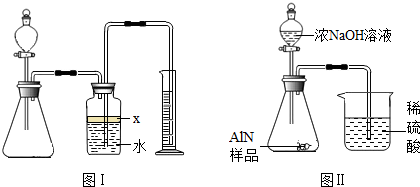
(1)实验有关操作为:a、往锥形瓶中放入适量的AlN样品:b、从分液漏斗往锥形瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为 .
(2)本试验中检查装置气密性的方法是 .
(3)广口瓶中的试剂X可选用 (填选项的标号).A 汽油 B 酒精 C 植物油 D CCl4
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将 (填偏大、偏小或不变).
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是 .
(6)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为 (AlN的相对分子质量为41,每22.4L氨气质量为17g).
(7)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行? (填入“可行”、“不可行”).原因是 ,改进的方法为 .
(8)在mg 20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀,称得剩余溶液总质量为3mg.
①计算所加硫酸镁溶液的质量分数;
②用N表示溶液中离子的数目,不同种离子用离子符号注明[如N (Na')表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图. 查看习题详情和答案>>

(1)实验有关操作为:a、往锥形瓶中放入适量的AlN样品:b、从分液漏斗往锥形瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为
(2)本试验中检查装置气密性的方法是
(3)广口瓶中的试剂X可选用
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
(6)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为
(7)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?
(8)在mg 20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀,称得剩余溶液总质量为3mg.
①计算所加硫酸镁溶液的质量分数;
②用N表示溶液中离子的数目,不同种离子用离子符号注明[如N (Na')表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图. 查看习题详情和答案>>
镇江某化工厂生产过程中排放的主要污染物是氯化氢,如果随意排放将会对大气和水资源造成重大污染.该工厂为了防治污染对废气处理流程图如下:
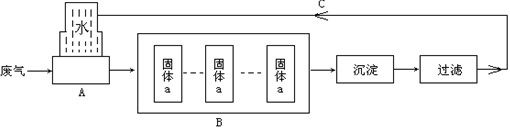
该厂通过该流程图既处理了废气,又为企业每年节约了几十万元的成本.
观察流程图后,回答以下问题:
(1)A装置是吸收氯化氢气体的装置,氯化氢溶于水形成的溶液俗称
(2)该厂对固体a在以下两种物质①烧碱、②工业生石灰中选择一种,你认为应该选择
(3)B操作中多次通过固体a的作用是
查看习题详情和答案>>

该厂通过该流程图既处理了废气,又为企业每年节约了几十万元的成本.
观察流程图后,回答以下问题:
(1)A装置是吸收氯化氢气体的装置,氯化氢溶于水形成的溶液俗称
盐酸
盐酸
,如任意排放污水会造成土壤酸化
酸化
.(2)该厂对固体a在以下两种物质①烧碱、②工业生石灰中选择一种,你认为应该选择
②
②
(填序号),理由是价格便宜,不会造成土壤碱化
价格便宜,不会造成土壤碱化
;有关的化学方程式是CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
、CaO+2HCl=CaCl2+H2O
CaO+2HCl=CaCl2+H2O
、Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
、CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.(3)B操作中多次通过固体a的作用是
充分吸收
充分吸收
,C操作的意义是废水利用,节约水资源,节约成本
废水利用,节约水资源,节约成本
.
随着社会的进步,我国的汽车工业发展迅速.请阅读下文,回答下列问题:
(1)为保证人员安全,汽车的安全气囊在汽车发生一定强度的碰撞时,利用叠氮化钠(NaN3)迅速分解成氮气和固态钠,气体充满气囊,以达到保护驾乘人员的目的.
①写出叠氮化钠分解反应的化学方程式 .
②若常温、常压下,要产生70L的氮气,则需要完全分解 g的叠氮化钠.(已知:常温常压下,氮气的密度约为1.2g/L.)
(2)催化转化器能将CO和NO2转化为N2 和CO2,从而减少一些有害气体的排放,但它并不能减少CO2气体的排放.CO2气体的大量排放能引起温室效应.为降低温室效应造成的危害,有人认为,空气中二氧化碳的含量越低越好,你认为这种说法是否正确?为什么? , .
查看习题详情和答案>>
(1)为保证人员安全,汽车的安全气囊在汽车发生一定强度的碰撞时,利用叠氮化钠(NaN3)迅速分解成氮气和固态钠,气体充满气囊,以达到保护驾乘人员的目的.
①写出叠氮化钠分解反应的化学方程式
②若常温、常压下,要产生70L的氮气,则需要完全分解
(2)催化转化器能将CO和NO2转化为N2 和CO2,从而减少一些有害气体的排放,但它并不能减少CO2气体的排放.CO2气体的大量排放能引起温室效应.为降低温室效应造成的危害,有人认为,空气中二氧化碳的含量越低越好,你认为这种说法是否正确?为什么?
2005年5月22日,中国登山测量队成功登上珠峰峰顶,圆满完成珠峰高度最新测量工作.登山队员常用的能源是氢化钙(CaH2)固体,CaH2与水反应生成氢气共燃烧之需.现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号Ⅰ、Ⅱ表示),图中铁架台等夹持固定装置已略去.
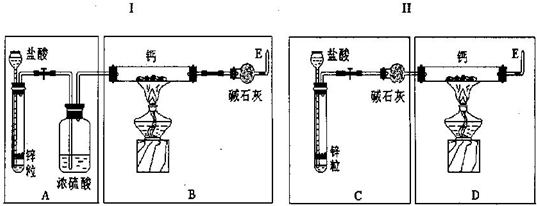
请回答下列问题
(1)制取氢化钙的化学方程式为:
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷.装置Ⅰ的不足之处是
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C…表示);
(4)登山队员常用CaH2与冰反应生成氢气,在产物中滴入无色酚酞试液后变红,写出CaH2和水反应的化学方程式:
(5)请你谈谈用氢化钙固体做能源的优点.
查看习题详情和答案>>

请回答下列问题
(1)制取氢化钙的化学方程式为:
Ca+H2
CaH2
| ||
Ca+H2
CaH2
;
| ||
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷.装置Ⅰ的不足之处是
制H2装置后缺少除HCl气体的装置
制H2装置后缺少除HCl气体的装置
,装置Ⅱ的不足之处是制CaH2装置后缺少干燥装置
制CaH2装置后缺少干燥装置
;(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C…表示);
(4)登山队员常用CaH2与冰反应生成氢气,在产物中滴入无色酚酞试液后变红,写出CaH2和水反应的化学方程式:
CaH2+2H2O=Ca(OH)2+2H2↑
CaH2+2H2O=Ca(OH)2+2H2↑
;(5)请你谈谈用氢化钙固体做能源的优点.