题目内容
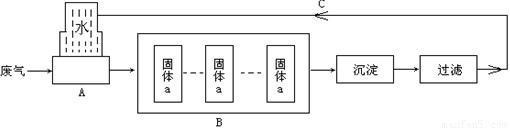
镇江某化工厂生产过程中排放的主要污染物是氯化氢,如果随意排放将会对大气和水资源造成重大污染.该工厂为了防治污染对废气处理流程图如下:
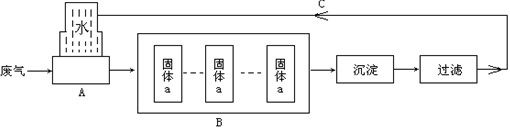
该厂通过该流程图既处理了废气,又为企业每年节约了几十万元的成本.
观察流程图后,回答以下问题:
(1)A装置是吸收氯化氢气体的装置,氯化氢溶于水形成的溶液俗称
(2)该厂对固体a在以下两种物质①烧碱、②工业生石灰中选择一种,你认为应该选择
(3)B操作中多次通过固体a的作用是

该厂通过该流程图既处理了废气,又为企业每年节约了几十万元的成本.
观察流程图后,回答以下问题:
(1)A装置是吸收氯化氢气体的装置,氯化氢溶于水形成的溶液俗称
盐酸
盐酸
,如任意排放污水会造成土壤酸化
酸化
.(2)该厂对固体a在以下两种物质①烧碱、②工业生石灰中选择一种,你认为应该选择
②
②
(填序号),理由是价格便宜,不会造成土壤碱化
价格便宜,不会造成土壤碱化
;有关的化学方程式是CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
、CaO+2HCl=CaCl2+H2O
CaO+2HCl=CaCl2+H2O
、Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
、CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.(3)B操作中多次通过固体a的作用是
充分吸收
充分吸收
,C操作的意义是废水利用,节约水资源,节约成本
废水利用,节约水资源,节约成本
.分析:(1)根据盐酸的形成过程和酸液的危害回答;
(2)根据氢氧化钠与生石灰的价格成本上考虑,根据氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙,这些物质都能与盐酸反应来写方程式;
(3)根据多次通过固体a是为了反应的充分,根据回收的好处考虑.
(2)根据氢氧化钠与生石灰的价格成本上考虑,根据氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙,这些物质都能与盐酸反应来写方程式;
(3)根据多次通过固体a是为了反应的充分,根据回收的好处考虑.
解答:解:(1)氯化氢溶于水形成的溶液就是盐酸;由于污水中含有盐酸所以任意排放污水会造成土壤酸化;
(2)由于生石灰比氢氧化钠便宜,成本低,不会造成土壤碱化,所以用生石灰;氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙,氧化钙与盐酸反应生成氯化钙和水,氢氧化钙与盐酸反应生成氯化钙利水,碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,二氧化碳后面标上上升符号;
(3)B操作中多次通过固体a的作用是将废气充分反应和吸收;C操作的意义是循环使用废液,使废水得到利用,节约水资源,节约成本.
故答案为:
(1)盐酸、酸化;
(2)②、价格便宜,不会造成土壤碱化;CaO+H2O=Ca(OH)2、CaO+2HCl=CaCl2+H2O、Ca(OH)2+2HCl=CaCl2+2H2O、CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)充分吸收;废水利用,节约水资源,节约成本.(其它合理答案均可)
(2)由于生石灰比氢氧化钠便宜,成本低,不会造成土壤碱化,所以用生石灰;氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙,氧化钙与盐酸反应生成氯化钙和水,氢氧化钙与盐酸反应生成氯化钙利水,碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,二氧化碳后面标上上升符号;
(3)B操作中多次通过固体a的作用是将废气充分反应和吸收;C操作的意义是循环使用废液,使废水得到利用,节约水资源,节约成本.
故答案为:
(1)盐酸、酸化;
(2)②、价格便宜,不会造成土壤碱化;CaO+H2O=Ca(OH)2、CaO+2HCl=CaCl2+H2O、Ca(OH)2+2HCl=CaCl2+2H2O、CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)充分吸收;废水利用,节约水资源,节约成本.(其它合理答案均可)
点评:解答本题的关键是要知道盐酸的形成过程,方程式的书写方法,了解废液利用的意义.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2009?镇江)某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
【工艺流程及原理】
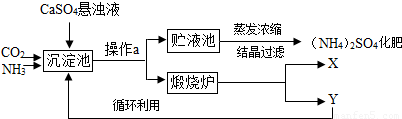
沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
【讨论交流】
(1)操作a的名称是______,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要______.
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用.Y的化学式为______.
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为______.
【硫酸铵化肥等级测定】
(1)判断(NH4)2SO4化肥中有无NH4HCO3:
取少量试样溶于水,滴加足量的______,无气泡产生,则可判断该化肥中不存在NH4HCO3.
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
【查阅资料】
①已知:(NH4)2SO4+2NaOH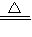 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
②工业判断硫酸铵化肥等级指标如下:
【实验设计】
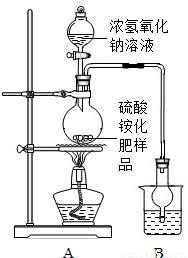
按右图所示装置进行实验.
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫酸铵充分反应完全转化为NH3.
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是______(填序号);
①水;②浓HCl;③稀H2SO4;④NaOH溶液
烧杯中干燥管的作用是______.
【交流讨论】
实验小组的同学认为,用上述实验装置测得的结果可能会出现下列情况.
(1)甲同学认为:应在实验装置A、B之间增加一个装有______(填“浓硫酸“或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高.
(2)乙同学认为:在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是______.
【实验测定】
经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验.
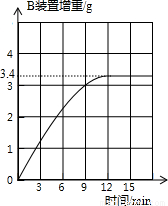
取硫酸铵化肥样品13.5 g进行实验,测得B装置增重与反应时间的关系如右图所示.请通过计算判断该化肥的等级.
计算过程:
该化肥的等级为______品.
【工艺流程及原理】

沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
【讨论交流】
(1)操作a的名称是______,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要______.
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用.Y的化学式为______.
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为______.
【硫酸铵化肥等级测定】
(1)判断(NH4)2SO4化肥中有无NH4HCO3:
取少量试样溶于水,滴加足量的______,无气泡产生,则可判断该化肥中不存在NH4HCO3.
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
【查阅资料】
①已知:(NH4)2SO4+2NaOH
 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
②工业判断硫酸铵化肥等级指标如下:
| 指标 项目 | 优等品 | 合格品 |
| 氮(N)含量 | ≥21.0% | ≥20.5% |
按右图所示装置进行实验.
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫酸铵充分反应完全转化为NH3.
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是______(填序号);
①水;②浓HCl;③稀H2SO4;④NaOH溶液
烧杯中干燥管的作用是______.
【交流讨论】
实验小组的同学认为,用上述实验装置测得的结果可能会出现下列情况.
(1)甲同学认为:应在实验装置A、B之间增加一个装有______(填“浓硫酸“或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高.
(2)乙同学认为:在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是______.
【实验测定】
经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验.
取硫酸铵化肥样品13.5 g进行实验,测得B装置增重与反应时间的关系如右图所示.请通过计算判断该化肥的等级.
计算过程:
该化肥的等级为______品.