摘要: 0.1mol有机物A重6.2g在O2中完全燃烧后生成CO2和H2O.产物通过足量的浓硫酸.浓硫酸的质量增加5.4g.再通过碱石灰.碱石灰的质量增加8.8g,若6.2g的A与足量的钠反应能产生0.1molH2.试确定该有机物A的分子式和结构简式 版权所有:() 版权所有:()
网址:http://m.1010jiajiao.com/timu3_id_308118[举报]
氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.
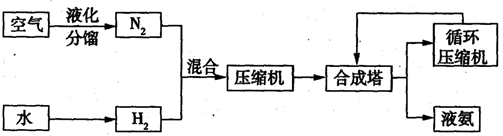
(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
(2)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
①依据表中数据判断,合成氨反应N2+3H2 2NH3的△H
2NH3的△H
②该反应的化学平衡常数表达式为
.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
查看习题详情和答案>>

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
氦气
氦气
.| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
天然气
天然气
为原料最好.②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
CH4+H2O
CO+3H2
| ||
| 高温 |
CH4+H2O
CO+3H2
.
| ||
| 高温 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
.(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H<
<
(填“>”、“<”或“无法判断”)0,请简要说明理由相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
;②该反应的化学平衡常数表达式为
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
0.66
0.66
倍. 铁是人类生产和生活中必不可少的重要金属(如图).
铁是人类生产和生活中必不可少的重要金属(如图).(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为
(2)铁原子中有
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积
(2013?德州一模)海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图1是工业 上对海水的几项综合利用的示意图(已知气体X为电解饱和食盐水所得;母液苦卤中主要 含有Ca2+、Mg2+,Cl-,SO42?、Br-等离子)请回答: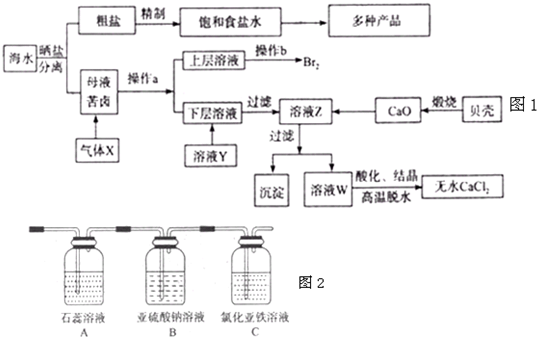
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
(2)气体X的化学式为
(3)加入溶液Y的目的是
(4)将气体X依次通过如图2所示装置以验证气体X的性质:
①通入气体X后,A中出现的现象是
②C装置中发生反应的离子方程式为
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)
查看习题详情和答案>>

(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
BDCA 或 CBDA 或BCDA等
BDCA 或 CBDA 或BCDA等
.(2)气体X的化学式为
Cl2
Cl2
,操作a所用的主要仪器是分液漏斗
分液漏斗
.(3)加入溶液Y的目的是
除去溶液中的SO42-
除去溶液中的SO42-
,用CaO调节溶液Z的pH,可以除去Mg2+得到溶液W.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2
11.0≤pH<12.2
.酸化溶液W时,使用的试剂为盐酸
盐酸
.| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
①通入气体X后,A中出现的现象是
溶液先变红,后褪色;
溶液先变红,后褪色;
.②C装置中发生反应的离子方程式为
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
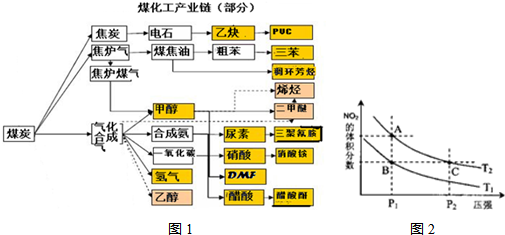
(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
(2)已知该产业链中某反应的平衡表达式为:
K=
它所对应的化学反应为:
(3)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g )?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是
(5)从图1看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中所有分子和离子( 除水和氨分子外)等微粒从大到小的顺序是
(7)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式
查看习题详情和答案>>

(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
N2+3H2?2NH3或NH3+HNO3═NH4NO3
N2+3H2?2NH3或NH3+HNO3═NH4NO3
(2)已知该产业链中某反应的平衡表达式为:
K=
| c(H2)c(CO) |
| c(H2O) |
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
(3)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g )?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:
K3=K1×K2
K3=K1×K2
.(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
放热
放热
反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:75%
75%
.(5)从图1看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式2NO2(g)?N2O4(g)△H=-57kJ?mol-1
2NO2(g)?N2O4(g)△H=-57kJ?mol-1
.对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是D
D
.A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中所有分子和离子( 除水和氨分子外)等微粒从大到小的顺序是
c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+)
c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+)
.(7)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式
CH3OH+8OH--6e-═CO32-+6H2O
CH3OH+8OH--6e-═CO32-+6H2O
.(2011?山东)实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
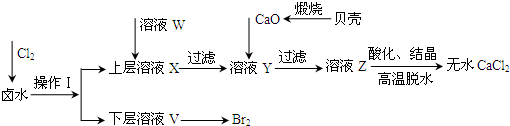
(1)操作Ⅰ使用的试剂是
(2)加入溶液W的目的是
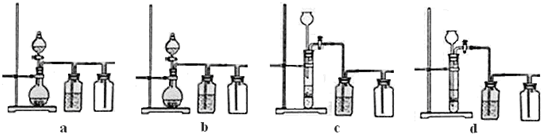
(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11.某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测量溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3.该实验设计不正确,错误在于
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论).
仪器自选.
供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸.
查看习题详情和答案>>

(1)操作Ⅰ使用的试剂是
四氯化碳
四氯化碳
,所用的主要仪器名称是分液漏斗
分液漏斗
.(2)加入溶液W的目的是
除去溶液中SO42-
除去溶液中SO42-
.用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择的pH最大范围是11.0≤pH≤12.2
11.0≤pH≤12.2
.酸化溶液Z时,使用的试剂为盐酸
盐酸
.| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
b、d
b、d
.
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11.某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测量溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3.该实验设计不正确,错误在于
用于比较pH的两种酸的物质的量浓度不相等
用于比较pH的两种酸的物质的量浓度不相等
.设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论).
三种参考方案如下:
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
三种参考方案如下:
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
.方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
仪器自选.
供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸.