题目内容
(2013?德州一模)海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图1是工业 上对海水的几项综合利用的示意图(已知气体X为电解饱和食盐水所得;母液苦卤中主要 含有Ca2+、Mg2+,Cl-,SO42?、Br-等离子)请回答: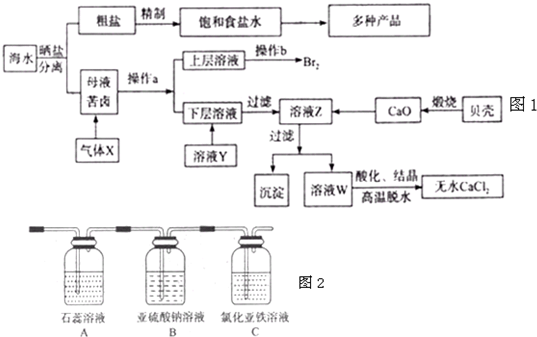
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
(2)气体X的化学式为
(3)加入溶液Y的目的是
(4)将气体X依次通过如图2所示装置以验证气体X的性质:
①通入气体X后,A中出现的现象是
②C装置中发生反应的离子方程式为
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)

(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
BDCA 或 CBDA 或BCDA等
BDCA 或 CBDA 或BCDA等
.(2)气体X的化学式为
Cl2
Cl2
,操作a所用的主要仪器是分液漏斗
分液漏斗
.(3)加入溶液Y的目的是
除去溶液中的SO42-
除去溶液中的SO42-
,用CaO调节溶液Z的pH,可以除去Mg2+得到溶液W.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2
11.0≤pH<12.2
.酸化溶液W时,使用的试剂为盐酸
盐酸
.| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
①通入气体X后,A中出现的现象是
溶液先变红,后褪色;
溶液先变红,后褪色;
.②C装置中发生反应的离子方程式为
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
.分析:(1)根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)由流程可知,X为Cl2,具有氧化性,能将溴离子氧化为溴单质;通过萃取将溴水中的溴萃取到有机溶剂中进行分液,利用分液漏斗分离;
(3)由流程可知,加入氯化钡除去SO42-,用CaO调节溶液Y的pH,可以除去Mg2+,分析表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;除杂时不能引入新的杂质;
(4)①根据氯气能与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有氧化性,能用于漂白;
②根据氯气有氧化性,能将二价铁氧化生成三价铁;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子;如果亚硫酸钠被氧化会生成硫酸钠,先排除亚硫酸根离子的干扰,然后根据硫酸根离子的检验方法检验即可.
(2)由流程可知,X为Cl2,具有氧化性,能将溴离子氧化为溴单质;通过萃取将溴水中的溴萃取到有机溶剂中进行分液,利用分液漏斗分离;
(3)由流程可知,加入氯化钡除去SO42-,用CaO调节溶液Y的pH,可以除去Mg2+,分析表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;除杂时不能引入新的杂质;
(4)①根据氯气能与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有氧化性,能用于漂白;
②根据氯气有氧化性,能将二价铁氧化生成三价铁;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子;如果亚硫酸钠被氧化会生成硫酸钠,先排除亚硫酸根离子的干扰,然后根据硫酸根离子的检验方法检验即可.
解答:解:(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为BDCA 或 CBDA 或BCDA等,
故答案为:BDCA或CBDA或BCDA等;
(2)由流程可知,X为Cl2,具有氧化性,能将溴离子氧化为溴单质;通过萃取将溴水中的溴萃取到有机溶剂中进行分液,利用分液漏斗分离,
故答案为:Cl2;分液漏斗;
(3)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;由表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,
故答案为:除去溶液中的SO42-;11.0≤pH<12.2;盐酸;
(4)①氯气能与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有氧化性,能用于漂白,所以通入氯气后,A中的现象是溶液先变红,后褪色,
故答案为:溶液先变红,后褪色;
②氯气有氧化性,能将二价铁氧化生成三价铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子:Cl2+SO32-+H2O=SO42-+2Cl-+2H+;如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化,
故答案为:取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
故答案为:BDCA或CBDA或BCDA等;
(2)由流程可知,X为Cl2,具有氧化性,能将溴离子氧化为溴单质;通过萃取将溴水中的溴萃取到有机溶剂中进行分液,利用分液漏斗分离,
故答案为:Cl2;分液漏斗;
(3)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;由表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,
故答案为:除去溶液中的SO42-;11.0≤pH<12.2;盐酸;
(4)①氯气能与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有氧化性,能用于漂白,所以通入氯气后,A中的现象是溶液先变红,后褪色,
故答案为:溶液先变红,后褪色;
②氯气有氧化性,能将二价铁氧化生成三价铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子:Cl2+SO32-+H2O=SO42-+2Cl-+2H+;如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化,
故答案为:取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
点评:本题考查了粗盐提纯的实验方案、溴的提取和氯气的性质运用,涉及到基本实验操作、离子的除杂和实验方案设计,综合性强,学习中注意积累化学知识,才能综合应用,题目难度中等.

练习册系列答案
相关题目
 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】