网址:http://m.1010jiajiao.com/timu3_id_304328[举报]
请回答下列问题:
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是
A.滴定终点读数时,俯视滴定管刻度,其他操作正确.
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定--取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol?L-1
的高锰酸钾溶液滴定,发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL) |
标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为
(3)沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是
A.NaCl B.NaBr C.NaCN D.Na2CrO4
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I 称取样品1.000 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式 。
⑵在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为 。
查看习题详情和答案>>I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I 称取样品1.000 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式 。
⑵在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为 。
查看习题详情和答案>>A.将溶液转移至250mL容量瓶中,加水至刻度线;
B.用移液管(或碱式滴定管)量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为m mol?L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1 mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点消耗酸的体积V2 mL.
回答下列问题:
(1)正确的操作步骤的顺序是(填写字母)
(2)滴定管读数应注意
(3)操作中的锥形瓶下垫一张白纸的作用是
(4)操作D中液面应调整到
(5)滴定到终点时锥形瓶内溶液的pH约为
(6)若酸式滴定管没有用标准H2SO4润洗,对测定结果有何影响
(7)该烧碱样品的纯度是
| 0.8m(V2-V1) |
| W |
| 0.8m(V2-V1) |
| W |
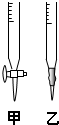 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.
某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
| 滴定次数 | 待测草酸溶液体积(mL) | 0.1000mol/LKMnO4标准溶液体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 10.02 |
| 第二次 | 25.00 | 0.22 | 11.32 |
| 第三次 | 25.00 | 1.56 | 11.54 |
(1)滴定时,将KMnO4标准液装在右图中的
(2)本实验滴定达到终点的标志可以是
(3)通过上述数据,计算出x=
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会