摘要: 在700K时,反应SO2(g)+1/2O2(g)SO3(g) 的平衡常数为K,则相同温度下反应2SO3(g)2SO2(g) + O2 A.(1/K)2 B.K2 C.1/K D.(K)-1/2
网址:http://m.1010jiajiao.com/timu3_id_304227[举报]
可逆反应A(g)+B(g)![]() C(g)在两个容积相等的容器中分别加入A、B各1mol,第一个容器在700K时达到平衡,压强为原来的75%,第二个容器在900K时达到平衡,混合气中A的体积分数为25%,通过计算判断该反应是放热还是吸热反应?
C(g)在两个容积相等的容器中分别加入A、B各1mol,第一个容器在700K时达到平衡,压强为原来的75%,第二个容器在900K时达到平衡,混合气中A的体积分数为25%,通过计算判断该反应是放热还是吸热反应?
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如下图.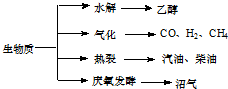
(1)下列有关说法正确的是 .
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇属生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等发酵获得的沼气,主要成是甲烷
(2)由生物质能获得的CO和H2,当两者1:1催化反应,其原子利用率达100%,合成的物质可能是 .
a.汽油 b.甲醇c.甲醛 d.乙酸
(3)已知在生物质气化炉中可发生:
C(s)+CO2(g)=2CO(g)△H=172kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=206kJ/mol
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=165kJ/mol
则:C(s)+H2O(g)=CO(g)+H2(g)△H= kJ/mol.
(4)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
反应:CO(g)+H2O(g)?CO2(g)+H2(g),该反应的△H 0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)= .
查看习题详情和答案>>

(1)下列有关说法正确的是
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇属生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等发酵获得的沼气,主要成是甲烷
(2)由生物质能获得的CO和H2,当两者1:1催化反应,其原子利用率达100%,合成的物质可能是
a.汽油 b.甲醇c.甲醛 d.乙酸
(3)已知在生物质气化炉中可发生:
C(s)+CO2(g)=2CO(g)△H=172kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=206kJ/mol
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=165kJ/mol
则:C(s)+H2O(g)=CO(g)+H2(g)△H=
(4)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
将1.00mol二氧化硫和1.00mol氧气通入1.00L的密闭容器中,分别在500K、600K、700K三个不同的温度下进行2SO2+O2?2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500K
表二:600K
表三:700K
(1)从上面三个表的数据可以判断该反应是 反应(填吸热或放热),利用表一计算0-40min内用
SO2表示该反应的化学反应速率v(SO2)= mol/L?min;
(2)对该反应,下面的说法正确的是 ;(双选)
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500K平衡状态时升高温度至600K时,重新达到平衡状态时,容器的压强减少
(3)从上面三个表的数据,温度对应该反应的反应速率和平衡移动的影响是 ;
(4)计算在600K时的平衡常数(写出计算过程,最后结果取两位有效数字) ;
(5)下图曲线(Ⅰ)是在500K时SO3浓度的变化曲线,请你在图中画出在550K进行上述反应的曲线,并标明曲线(Ⅱ).
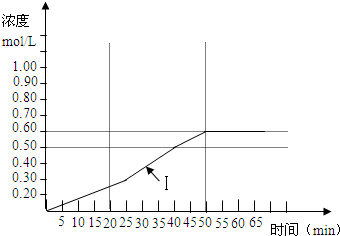
查看习题详情和答案>>
表一:500K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3 浓度(mol/L) |
0 | 0.1 | 0.15 | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.2 | 0.30 | 0.40 | 0.50 | 0.50 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
SO2表示该反应的化学反应速率v(SO2)=
(2)对该反应,下面的说法正确的是
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500K平衡状态时升高温度至600K时,重新达到平衡状态时,容器的压强减少
(3)从上面三个表的数据,温度对应该反应的反应速率和平衡移动的影响是
(4)计算在600K时的平衡常数(写出计算过程,最后结果取两位有效数字)
(5)下图曲线(Ⅰ)是在500K时SO3浓度的变化曲线,请你在图中画出在550K进行上述反应的曲线,并标明曲线(Ⅱ).

Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
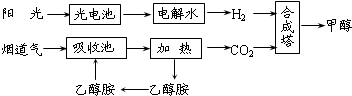
(1)该合成路线对于环境保护的价值在于 .
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因 .
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: .
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
(4)该反应的焓变△H 0,熵变△S 0(填>、<或=).
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12L?min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9℃),用该电池电解500mL 2mol?L-1CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
查看习题详情和答案>>

(1)该合成路线对于环境保护的价值在于
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
| 催化剂 |
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式
 (2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ.mol-l
CH4(g)十4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ.mol-l
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ/mol
.(2)将燃煤废气中的C02转化为甲醚的反应原理为:2CO2(g)+6H2(g)
| 催化剂 |
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比 | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
减小
减小
(填“增大”、“减小”或“不变”.下同);若温度不变,提高投料比,则K将不变
不变
.该反应的△H<
<
0(填“>、<或=”):②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
CH3OCH3-12e-+16OH-=2CO32-+11H2O
CH3OCH3-12e-+16OH-=2CO32-+11H2O
.③利用甲醚燃料电池设计如图所示的装置:则该装置中Zn极为
阴
阴
极;B中Cu2+向Zn
Zn
极(填Zn或Cu)移动.当Zn片的质量变化为6.4g时,a极上消耗的O2在标准状况下的体积为1.12
1.12
L.