摘要: (1)H2O(2) NaOH + HCl→NaCl + H2O 2,复分解反应 (4)三种固体各取少量于试管中.分别加入足量的水.不能溶解的.则证明原物质是碳酸钙.再向另两支试管中分别加入少量稀盐酸.能产生气体的.则证明原物质是碳酸钠.无现象的.则证明原物质是氯化钠.
网址:http://m.1010jiajiao.com/timu3_id_30001[举报]
30、下列是初中化学常见的物质,根据要求回答问题:
(1)A、B是由同种元素组成的液态物质,且A在一定条件下反应生成B和C,则B的化学式为
(2)D和F含有相同金属元素,F为生活中常用的食品防腐剂,D与E反应生成F和B,D与E反应的化学方程式是
(3)M+H→K+B;N+H→K+D,则H的化学式是
(4)能鉴别以上出现的盐的方法是
查看习题详情和答案>>
(1)A、B是由同种元素组成的液态物质,且A在一定条件下反应生成B和C,则B的化学式为
H2O
.(2)D和F含有相同金属元素,F为生活中常用的食品防腐剂,D与E反应生成F和B,D与E反应的化学方程式是
NaOH+HCl═NaCl+H2O
.(3)M+H→K+B;N+H→K+D,则H的化学式是
Ca(OH)2
;N+H→K+D的反应类型是复分解反应
.(4)能鉴别以上出现的盐的方法是
三种固体各取少量于试管中,分别加入足量的水,不能溶解的,则证明原物质是碳酸钙,再向另两支试管中分别加入少量稀盐酸,能产生气体的,则证明原物质是碳酸钠,无现象的,则证明原物质是氯化钠
.A~F是初中化学常见物质,回答下列问题:
①A与水反应生成B,该反应能放出大量的热.A的俗称是
②C与D反应生成E和水,E是日常生活中常用的调味品.E的化学式为
③B与F反应是工业制D的方法.该反应的化学方程式为
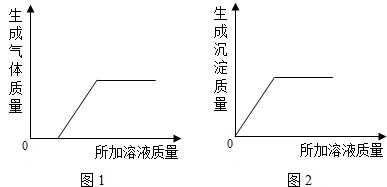
④用B、C、D、E、F溶液进行实验,取其中两种溶液混合(不发生化学反应),再加入剩余溶液中的一种,生成气体(或沉淀)的质量与所加溶液的质量关系如图所示.若产生如图1所示的现象,且混合溶液中的两种溶质均由三种元素组成.写出有关反应的化学方程式为
查看习题详情和答案>>

①A与水反应生成B,该反应能放出大量的热.A的俗称是
生石灰
生石灰
;②C与D反应生成E和水,E是日常生活中常用的调味品.E的化学式为
NaCl
NaCl
,该反应的基本反应类型为复分解反应
复分解反应
;③B与F反应是工业制D的方法.该反应的化学方程式为
Ca(OH)2+Na2CO3═2NaOH+CaCO3↓
Ca(OH)2+Na2CO3═2NaOH+CaCO3↓
;④用B、C、D、E、F溶液进行实验,取其中两种溶液混合(不发生化学反应),再加入剩余溶液中的一种,生成气体(或沉淀)的质量与所加溶液的质量关系如图所示.若产生如图1所示的现象,且混合溶液中的两种溶质均由三种元素组成.写出有关反应的化学方程式为
HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
;若产生如图2所示的现象,则混合溶液中所含溶质的化学式为NaOH Ca(OH)2
NaOH Ca(OH)2
,所加溶液中溶质的化学式为Na2CO3
Na2CO3
.小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
【探究一】为探究气体的成分,同学们设计如图1实验装置进行实验.
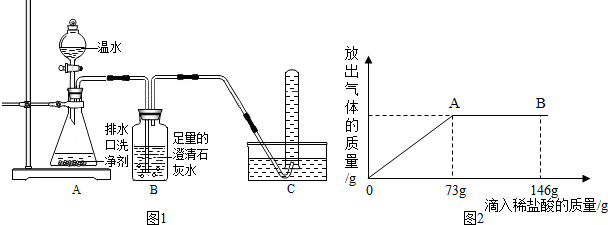
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体是
【探究二】为探究过碳酸钠溶于水后所得溶液中溶质的成分,同学们找来过碳酸钠试剂进行实验.
(1)实验过程及现象:取少量过碳酸钠试剂溶于温水中,发现有气泡缓缓冒出,形成无色溶液X;取少量溶液X加入MnO2,发现迅速产生大量气泡,用带火星木条放在管口,木条复燃.
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是
(4)查找资料:资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀.
(5)实验过程:小强同学取少量溶液,加入稀盐酸,有大量气泡产生,得出结论溶液中含有碳酸钠.其他同学提出异议,理由是
(6)实验反思:根据资料,NaHCO3溶液能与石灰水反应生成白色沉淀.于是,同学们猜想:碳酸氢钠与氢氧化钠是否可以发生
【探究三】某同学带来一包膨松剂,想要探究其成分究竟是碳酸钠还是碳酸氢钠,查阅资料得知,向碳酸钠溶液中逐滴滴加稀盐酸,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,其后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.现取少量粉末溶于水,向其中逐滴滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图2所示,请根据题意回答问题:
(1)该膨松剂成分为
(2)实验中放出二氧化碳多少克?(写出计算过程)
查看习题详情和答案>>
【探究一】为探究气体的成分,同学们设计如图1实验装置进行实验.

实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体是
O2、CO2
O2、CO2
(填化学式).【探究二】为探究过碳酸钠溶于水后所得溶液中溶质的成分,同学们找来过碳酸钠试剂进行实验.
(1)实验过程及现象:取少量过碳酸钠试剂溶于温水中,发现有气泡缓缓冒出,形成无色溶液X;取少量溶液X加入MnO2,发现迅速产生大量气泡,用带火星木条放在管口,木条复燃.
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是
H2O2
H2O2
;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.(4)查找资料:资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀.
(5)实验过程:小强同学取少量溶液,加入稀盐酸,有大量气泡产生,得出结论溶液中含有碳酸钠.其他同学提出异议,理由是
NaHCO3与稀盐酸反应也产生气泡
NaHCO3与稀盐酸反应也产生气泡
.更改方案后,小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.| 实验操作 | 主要实验现象 | 结论 |
| ①取样,滴加 CaCl2 CaCl2 溶液 |
出现白色沉淀 出现白色沉淀 |
证明溶液中有Na2CO3 |
| ②取上层清液,滴加 Ca(OH)2 Ca(OH)2 溶液 |
无白色沉淀产生 | 证明溶液中无NaHCO3 |
| ③取样, 加入过量氯化钙溶液,充分反应后滴加酚酞试剂 加入过量氯化钙溶液,充分反应后滴加酚酞试剂 |
不变色 不变色 |
证明溶液中无NaOH |
NaHCO3+NaOH═Na2CO3+H2O
NaHCO3+NaOH═Na2CO3+H2O
(写方程式)这样的反应?【探究三】某同学带来一包膨松剂,想要探究其成分究竟是碳酸钠还是碳酸氢钠,查阅资料得知,向碳酸钠溶液中逐滴滴加稀盐酸,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,其后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.现取少量粉末溶于水,向其中逐滴滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图2所示,请根据题意回答问题:
(1)该膨松剂成分为
碳酸氢钠或NaHCO3
碳酸氢钠或NaHCO3
,当滴加稀盐酸至图2中B点时,烧杯中溶液的pH<
<
7(填>、=、<).(2)实验中放出二氧化碳多少克?(写出计算过程)