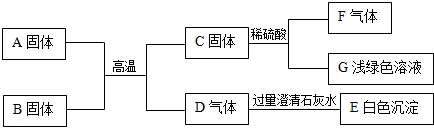
题目内容
A~F是初中化学常见物质,回答下列问题:
①A与水反应生成B,该反应能放出大量的热.A的俗称是
②C与D反应生成E和水,E是日常生活中常用的调味品.E的化学式为
③B与F反应是工业制D的方法.该反应的化学方程式为
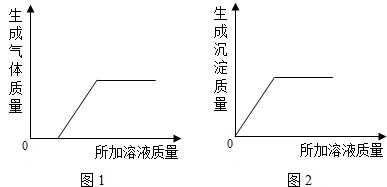
④用B、C、D、E、F溶液进行实验,取其中两种溶液混合(不发生化学反应),再加入剩余溶液中的一种,生成气体(或沉淀)的质量与所加溶液的质量关系如图所示.若产生如图1所示的现象,且混合溶液中的两种溶质均由三种元素组成.写出有关反应的化学方程式为

①A与水反应生成B,该反应能放出大量的热.A的俗称是
生石灰
生石灰
;②C与D反应生成E和水,E是日常生活中常用的调味品.E的化学式为
NaCl
NaCl
,该反应的基本反应类型为复分解反应
复分解反应
;③B与F反应是工业制D的方法.该反应的化学方程式为
Ca(OH)2+Na2CO3═2NaOH+CaCO3↓
Ca(OH)2+Na2CO3═2NaOH+CaCO3↓
;④用B、C、D、E、F溶液进行实验,取其中两种溶液混合(不发生化学反应),再加入剩余溶液中的一种,生成气体(或沉淀)的质量与所加溶液的质量关系如图所示.若产生如图1所示的现象,且混合溶液中的两种溶质均由三种元素组成.写出有关反应的化学方程式为
HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
;若产生如图2所示的现象,则混合溶液中所含溶质的化学式为NaOH Ca(OH)2
NaOH Ca(OH)2
,所加溶液中溶质的化学式为Na2CO3
Na2CO3
.分析:①A能与水反应放出大量的热,可以判断A为氧化钙,而B为氢氧化钙,可以据此解答;
②E是日常生活中常用的调味品.可以知道E为氯化钠,而C和D的反应为稀盐酸和氢氧化钠的反应,可以据此解答;
③根据①②的解答结合题给的信息可以知道D为氢氧化钠,所以可以判断F为碳酸钠,可以据此解答该题;
④所给物质中能够反应生成气体的只有碳酸钠和稀盐酸,而根据图1可以知道,反应之初并没有产生气体,说明该混合溶液中含有碱,即图1所取的两种溶液为氢氧化钠和碳酸钠,而加入的物质为稀盐酸;根据图2的信息可以知道所取的两种溶液之间没有发生反应,而加入另一种物质之后马上产生了沉淀,结合上述推断可以完成解答.
②E是日常生活中常用的调味品.可以知道E为氯化钠,而C和D的反应为稀盐酸和氢氧化钠的反应,可以据此解答;
③根据①②的解答结合题给的信息可以知道D为氢氧化钠,所以可以判断F为碳酸钠,可以据此解答该题;
④所给物质中能够反应生成气体的只有碳酸钠和稀盐酸,而根据图1可以知道,反应之初并没有产生气体,说明该混合溶液中含有碱,即图1所取的两种溶液为氢氧化钠和碳酸钠,而加入的物质为稀盐酸;根据图2的信息可以知道所取的两种溶液之间没有发生反应,而加入另一种物质之后马上产生了沉淀,结合上述推断可以完成解答.
解答:解:①A能与水反应放出大量的热,可以判断A为氧化钙,而B为氢氧化钙,其中氧化钙俗称生石灰;
②E是日常生活中常用的调味品.可以知道E为氯化钠,其化学式为:NaCl;而C和D的反应为稀盐酸和氢氧化钠的反应,该反应属于复分解反应;
③根据①②的解答结合题给的信息可以知道D为氢氧化钠,所以可以判断F为碳酸钠,即B和F的反应为氢氧化钙和碳酸钠的反应,其化学方程式为:Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;
④所给物质中能够反应生成气体的只有碳酸钠和稀盐酸,而根据图1可以知道,反应之初并没有产生气体,说明该混合溶液中含有碱,即图1所取的两种溶液为氢氧化钠和碳酸钠,而加入的物质为稀盐酸,所涉及的化学方程式为:HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;根据图2的信息可以知道所取的两种溶液之间没有发生反应,而加入另一种物质之后马上产生了沉淀,不会是盐酸参加的反应,碳酸钠能与氢氧化钙反应生成碳酸钙沉淀,所以本题可能的组合为:①Na2CO3 NaCl所加溶液为Ca(OH)2;②NaOH Ca(OH)2所加溶液为Na2CO3;③Ca(OH)2 NaCl所加溶液为:Na2CO3;④NaOH Na2CO3所加溶液为Ca(OH)2.
故答案为:①生石灰;
②NaCl;复分解反应;
③Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;
④HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;①Na2CO3 NaCl所加溶液为Ca(OH)2;②NaOH Ca(OH)2所加溶液为Na2CO3;③Ca(OH)2 NaCl所加溶液为:Na2CO3;④NaOH Na2CO3所加溶液为Ca(OH)2.(任选一种组合即可)
②E是日常生活中常用的调味品.可以知道E为氯化钠,其化学式为:NaCl;而C和D的反应为稀盐酸和氢氧化钠的反应,该反应属于复分解反应;
③根据①②的解答结合题给的信息可以知道D为氢氧化钠,所以可以判断F为碳酸钠,即B和F的反应为氢氧化钙和碳酸钠的反应,其化学方程式为:Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;
④所给物质中能够反应生成气体的只有碳酸钠和稀盐酸,而根据图1可以知道,反应之初并没有产生气体,说明该混合溶液中含有碱,即图1所取的两种溶液为氢氧化钠和碳酸钠,而加入的物质为稀盐酸,所涉及的化学方程式为:HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;根据图2的信息可以知道所取的两种溶液之间没有发生反应,而加入另一种物质之后马上产生了沉淀,不会是盐酸参加的反应,碳酸钠能与氢氧化钙反应生成碳酸钙沉淀,所以本题可能的组合为:①Na2CO3 NaCl所加溶液为Ca(OH)2;②NaOH Ca(OH)2所加溶液为Na2CO3;③Ca(OH)2 NaCl所加溶液为:Na2CO3;④NaOH Na2CO3所加溶液为Ca(OH)2.
故答案为:①生石灰;
②NaCl;复分解反应;
③Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;
④HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;①Na2CO3 NaCl所加溶液为Ca(OH)2;②NaOH Ca(OH)2所加溶液为Na2CO3;③Ca(OH)2 NaCl所加溶液为:Na2CO3;④NaOH Na2CO3所加溶液为Ca(OH)2.(任选一种组合即可)
点评:本题考查了常见物质的推断,完成此题,可以依据已有的知识结合题干提供的信息进行,要求同学们在平时的学习中加强基础知识的储备,以便灵活应用.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
 30、A~F是初中化学常见物质.
30、A~F是初中化学常见物质. A~F是初中化学常见的6种物质,它们在一定条
A~F是初中化学常见的6种物质,它们在一定条 (2012?南昌)如图所示A~F是初中化学常见的物质.图中“→”表示转化关系,“→”表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.
(2012?南昌)如图所示A~F是初中化学常见的物质.图中“→”表示转化关系,“→”表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸. A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答:
A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答: