摘要:17.短周期三种元素X.Y.Z.位于周期表中同一周期.它们的最高价氧化物对应的水化物的化学式分别为HXO4.H2YO4.H3ZO4.则下列判断中.正确的是 A.三种酸的酸性由强到弱的顺序为:H3ZO4>H2YO4>HXO4 B.三种元素的非金属性由弱到强的顺序为:Z<Y<X C.单质的氧化性由强到弱的顺序为:Z>Y>X D.三种元素的气态氢化物的稳定性由弱到强的顺序为:X<Y<Z
网址:http://m.1010jiajiao.com/timu3_id_298320[举报]
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
(1)W在周期表中的位置: .
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2(g)+Y2(g)?2YX3(g)△H
反应各物质的量浓度随时间变化如图:
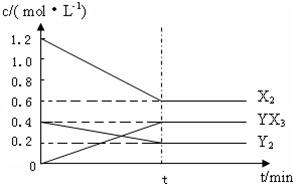
①此反应的平衡常数表达式为 (用化学式表示),K= .
②若升高温度平衡常数K减小,则△H 0(填“>”,“<”).
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为 .
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是 .
(5)A2和B1反应生成B2,则0.2mol/LA2和0.1mol/L B1等体积混合后溶液中离子浓度大小关系为 .
查看习题详情和答案>>
(1)W在周期表中的位置:
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2(g)+Y2(g)?2YX3(g)△H
反应各物质的量浓度随时间变化如图:

①此反应的平衡常数表达式为
②若升高温度平衡常数K减小,则△H
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是
(5)A2和B1反应生成B2,则0.2mol/LA2和0.1mol/L B1等体积混合后溶液中离子浓度大小关系为
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17.
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):
(2)Y是
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.写出该化合物的名称及化学式
查看习题详情和答案>>
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17.
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):
否
否
,理由是若三者处于同一周期,则最外层电子数之和不可能为17
若三者处于同一周期,则最外层电子数之和不可能为17
(2)Y是
N
N
,Z是O
O
,W是S
S
;(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.写出该化合物的名称及化学式
硫酸铵(NH4)2SO4
硫酸铵(NH4)2SO4
.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为
(2)Z的单质与水反应的化学方程式是
(3)Y与R相比,非金属性较强的是
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是
查看习题详情和答案>>
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
同位素
同位素
;R在元素周期表中的位置是第三周期ⅦA族
第三周期ⅦA族
.(2)Z的单质与水反应的化学方程式是
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.(3)Y与R相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列事实能证明这一结论的是bc
bc
(选填字母序号).a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是
大于0.099nm小于0.143nm
大于0.099nm小于0.143nm
.X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价.回答下列问题:
(1)元素X原子结构示意图为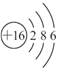
 .
.
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是
(3)元素Z能与氢元素形成-1价阴离子,该阴离子的电子总数是
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为
(5)ZW3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为
(6)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是
查看习题详情和答案>>
(1)元素X原子结构示意图为


(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是
146C
146C
.(3)元素Z能与氢元素形成-1价阴离子,该阴离子的电子总数是
10
10
,与该离子电子总数相等的Z与氢形成的微粒是NH3、NH4+
NH3、NH4+
.(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为
Cl2+SO2+2H2O═4H++2Cl-+SO42-
Cl2+SO2+2H2O═4H++2Cl-+SO42-
删除此空
删除此空
.(5)ZW3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为
NCl3+4H2O═3HClO+NH3?H2O
NCl3+4H2O═3HClO+NH3?H2O
.(6)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是
H2CO3
H2CO3
(用酸的分子式表示).X、Y、Z、M、G五种短周期主族元素,原子序数依次增大.X元素的气态氢化物水溶液呈碱性;Y、M同主族,可形成MY2、MY3两种分子;元素Z和G可形成1:1的离子化合物.
请回答下列问题:
(1)Y在元素周期表中的位置为
 .
.
(2)X元素的气态氢化物的电子式为
 ,M的最高价氧化物对应水化物的化学式为
,M的最高价氧化物对应水化物的化学式为
(3)Z、M、G三种元素的原子半径从大到小的顺序为
(4)元素Y和Z按原子个数1:1形成的化合物中存在
(5)能说明元素G的非金属性比元素M的非金属性强的是
①最高价氧化物对应水化物的酸性:G比M强
②气态氢化物的还原性:M比G强
③气态氢化物溶于水后的酸性:G比M强
④G的最高正价比M的最高正价高
(6)M和X可形成一种化合物,其相对分子质量在170~190之间,且M的质量分数
约为70%.该化合物的化学式为
查看习题详情和答案>>
请回答下列问题:
(1)Y在元素周期表中的位置为
第二周期ⅥA族
第二周期ⅥA族
,Z离子的结构示意图为

(2)X元素的气态氢化物的电子式为


H2SO4
H2SO4
.(3)Z、M、G三种元素的原子半径从大到小的顺序为
Na>S>Cl
Na>S>Cl
(用元素符号表示).(4)元素Y和Z按原子个数1:1形成的化合物中存在
离子键、共价键
离子键、共价键
化学键.(5)能说明元素G的非金属性比元素M的非金属性强的是
①②
①②
(填编号).①最高价氧化物对应水化物的酸性:G比M强
②气态氢化物的还原性:M比G强
③气态氢化物溶于水后的酸性:G比M强
④G的最高正价比M的最高正价高
(6)M和X可形成一种化合物,其相对分子质量在170~190之间,且M的质量分数
约为70%.该化合物的化学式为
S4N4
S4N4
.