题目内容
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为
(2)Z的单质与水反应的化学方程式是
(3)Y与R相比,非金属性较强的是
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
同位素
同位素
;R在元素周期表中的位置是第三周期ⅦA族
第三周期ⅦA族
.(2)Z的单质与水反应的化学方程式是
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.(3)Y与R相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列事实能证明这一结论的是bc
bc
(选填字母序号).a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是
大于0.099nm小于0.143nm
大于0.099nm小于0.143nm
.分析:X、Y、Z、M、R、Q是短周期主族元素,X元素的阳离子核外无电子,则X为氢元素;Y元素有-4、+4价,处于ⅣA族,是无机非金属材料的主角,则Y为Si元素;Z元素焰色反应呈黄色,则Z为Na元素;R元素有+7、-1价,则R为Cl元素;M元素有-2价,处于ⅥA族,原子半径小于Cl原子,故R为氧元素;Q有+3价,处于ⅢA族,原子半径大于Cl原子,则Q为Al元素,据此解答.
解答:解:X、Y、Z、M、R、Q是短周期主族元素,X元素的阳离子核外无电子,则X为氢元素;Y元素有-4、+4价,处于ⅣA族,是无机非金属材料的主角,则Y为Si元素;Z元素焰色反应呈黄色,则Z为Na元素;R元素有+7、-1价,则R为Cl元素;M元素有-2价,处于ⅥA族,原子半径小于Cl原子,故R为氧元素;Q有+3价,处于ⅢA族,原子半径大于Cl原子,则Q为Al元素,
(1)Cl在自然界中有质量数为35和37的两种核素,它们之间的关系是互为同位素;Cl元素原子有3个电子层.最外层电子数为7,处于周期表中第三周期ⅦA族,
故答案为:同位素;第三周期ⅦA族;
(2)Na与水反应生成氢氧化钠与氢气,反应化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)同周期自左而右非金属性增强,故非金属性Cl>Si,
a.物质的聚集状态属于物理性质,不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,稳定性HCl>SiH4,说明非金属性Cl>Si,故b正确;
c.Si与Cl形成的化合物中Si呈正价,说明Cl吸引电子的能力强,Cl元素的非金属性更强,故c正确;
故答案为:Cl;bc;
(4)同周期自左而右原子半径减小,故原子半径Cl<Si<Al,故Si的原子半径的最小范围是大于0.099nm小于0.143nm,
故答案为:大于0.099nm小于0.143nm.
(1)Cl在自然界中有质量数为35和37的两种核素,它们之间的关系是互为同位素;Cl元素原子有3个电子层.最外层电子数为7,处于周期表中第三周期ⅦA族,
故答案为:同位素;第三周期ⅦA族;
(2)Na与水反应生成氢氧化钠与氢气,反应化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)同周期自左而右非金属性增强,故非金属性Cl>Si,
a.物质的聚集状态属于物理性质,不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,稳定性HCl>SiH4,说明非金属性Cl>Si,故b正确;
c.Si与Cl形成的化合物中Si呈正价,说明Cl吸引电子的能力强,Cl元素的非金属性更强,故c正确;
故答案为:Cl;bc;
(4)同周期自左而右原子半径减小,故原子半径Cl<Si<Al,故Si的原子半径的最小范围是大于0.099nm小于0.143nm,
故答案为:大于0.099nm小于0.143nm.
点评:本题考查结构性质位置关系、元素周期律等,难度不大,利用原子半径及化合价来推断出元素是解答本题的关键.

练习册系列答案
相关题目
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
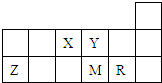 短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )